Оглавление
Введение
. Сущность обратного осмоса
. Установки обратного осмоса
. Обратноосмотические мембраны
. Обратноосмотические аппараты
Литература
Введение
Целью данной работы является описание принципа работы и основных особенностей технического исполнения современных аппаратов и установок, работающих по принципу обратного осмоса.
Обратный осмос широко применяется в системах водоподготовки, при концентрировании и фракционировании растворов, для опреснения и умягчения морской воды, для очистки промышленных сточных вод от тяжелых металлов и высокомолекулярных соединений, очистки технологических растворов и воды от тонкодисперсных примесей, а также в других областях промышленности [1].
Для раскрытия темы и реализации обозначенной цели, оптимальной представляется следующая структура: описание физических процессов, обеспечивающих протекание процесса (глава 1); принципиальная схема установки обратного осмоса, возможные варианты её реализации (глава 2); обратноосмотические мембраны, их основные параметры и характеристики (глава 3); аппараты обратного осмоса, принципиальные различия в пространственной ориентации мембран (глава 4).
В заключении будут приведены положительные и отрицательные аспекты данной технологии очистки.
обратный осмос мембрана аппарат
Сущность обратного осмоса
Обратный осмос относится к баромембранным процессам водоподготовки, осуществляемым под действием перепада давления через разделительную полупроницаемую мембранную перегородку[1]. Принцип их действия основан на том, что под влиянием внешнего давления молекулы растворителя (вода) и ионы некоторых растворенных веществ (например, солей) проходят через полупроницаемую мембрану, тогда как другие молекулы или заряженные ионы в различной мере задерживаются мембраной или не проходят сквозь нее.
Отличие баромембранных процессов от обычной фильтрации заключаются в том, что при фильтрации продукт откладывается в виде кристаллического или аморфного осадка на поверхности фильтра, в то время как в баромембранных процессах образуются два раствора, один из которых обогащен растворенным веществом. В этих процессах накопление вещества у поверхности мембраны недопустимо, так как приводит к снижению селективности и проницаемости [1].
Понятие "обратный осмос" показывает обратимость естественного (прямого) осмоса, который характеризуется самопроизвольным переходом растворителя через полупроницаемую мембрану в раствор. На рисунке 1 приведены схемы прямого и обратного осмоса.
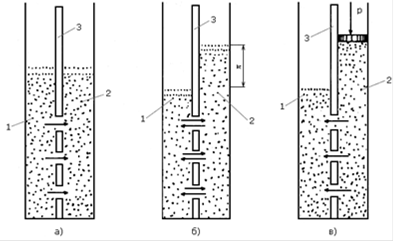
Рисунок 1. Принципиальная схема прямого и обратного осмоса: а - начало осмотического переноса; б - равновесное состояние; в - обратный осмос; 1 - пресная вода; 2 - соленая вода; 3 - мембрана; p - осмотическое давление раствора
Если чистую воду и водный раствор какого-либо неорганического вещества поместить в два отсека по обе стороны полупроницаемой мембраны, способной пропускать только молекулы воды, то в такой системе будет наблюдаться следующее[2]. Из-за разности давления (концентрации) молекул воды в разных отсеках происходит переход молекул воды в объем с их меньшей концентрацией, т.е. в отсек солевого раствора, объем которого постепенно увеличивается, раствор разбавляется, разность давлений уменьшается, тормозя дальнейший перенос молекул воды. В состоянии равновесия уровни в обеих частях ячейки не будут изменяться, а установившееся гидростатическое давление определяется как осмотическое давление раствора. Осмотическое давление раствора p определяется согласно закону Вант-Гоффа и может быть записано в виде выражения 1:

| (1) |
где i - коэффициент Вант-Гоффа, R - универсальная газовая постоянная, равная 8.31 Дж/(моль·К); T - температура раствора, К; C - концентрация растворенного вещества, г/дм3; M - масса 1 моля растворенного вещества, г.
Коэффициент Вант-Гоффа равен среднему суммарному числу частиц, образующихся при электролитической диссоциации одной молекулы (формула 2):

| (2) |
где n - общее число ионов, образующихся при диссоциации одной молекулы,  - степень диссоциации растворенного вещества. Для хорошо растворимых веществ в разведенных растворах диссоциацию можно считать полной, и в этих случаях коэффициент Вант-Гоффа можно использовать как целую величину, соответствующую числу образовавшихся ионов (например, для NaCl i = 2).
- степень диссоциации растворенного вещества. Для хорошо растворимых веществ в разведенных растворах диссоциацию можно считать полной, и в этих случаях коэффициент Вант-Гоффа можно использовать как целую величину, соответствующую числу образовавшихся ионов (например, для NaCl i = 2).
Из уравнений 1 и 2 следует, что осмотическое давление раствора зависит от химической природы растворенного вещества и его концентрации.
Движущей силой процесса является разность давлений по обе стороны мембраны(формула 3):

| (3) |
где P - давление над исходным раствором (сырьем),  и
и  соответственно осмотическое давление раствора (сырья) и растворителя (пермеата, фильтрата).
соответственно осмотическое давление раствора (сырья) и растворителя (пермеата, фильтрата).
Химическая структура полимера, из которого изготавливается мембрана такова, что вода может образовывать водородные связи с функциональными группами полимера. При этом образуется слой связанной с мембраной воды, как это показано на рисунке 2. Связанная вода образует упорядоченную структуру и не обладает способностью растворять в себе (гидратировать) электролиты. Тогда при приложении к раствору давления, превышающего осмотическое, через поры мембраны, имеющие диаметр меньше, чем размер областей связанной воды (пора 1), будет проникать - только чистая вода, то есть в этом случае диаметр "перекрывается" слоями связанной воды. Только чистая вода будет проникать через мембрану и в том случае, если поры не "перекрываются" связанной водой, но этот не перекрытый диаметр меньше диаметра гидратированного иона (пора 2). И только поры если размер пор настолько велик, что в них по области свободной воды может проникнуть гидратированный ион, то через эти поры будет проникать исходный раствор[3].

Рисунок 2. Схема Взаимодействия воды с с мембраной.
Итак, в отличие от микро- и ультрафильтрации, где разделение происходит исключительно по размерам частиц и материал мембраны не влияет на ее задерживающую способность, в обратном осмосе разделение происходит благодаря избирательному взаимодействию одного из компонентов смеси (воды) с материалом мембраны. Вода образует водородные связи с функциональными группами полимера, из которого изготовлена мембрана [3].