Реферат
На тему: «Химические свойства, способы получения, применение спиртов»
Работу выполнил:
Аверьянов Дмитрий
10 «И» ГБОУ Школа № 1474
МОСКВА
2018 год
Оглавление:
Введение. 3
1. Классификация спиртов. 4
2. Строение и физические свойства спиртов. 5
3. Химические свойства спиртов. 7
4. Получение спиртов. 10
5. Отдельные представители, применение. 11
Заключение. 14
Список литературы и других источников. 15
Введение
Спирты являются одними из наиболее древних веществ, когда-либо синтезированных человеком. Ещё в IV веке до нашей эры люди изготавливали напитки, содержащие этиловый спирт. Вино получали сбраживанием фруктовых и ягодных соков, однако выделять из него дурманящий компонент научились значительно позже. В XI веке алхимики обнаружили, что при нагревании вина образуются пары летучего вещества, которые при охлаждении конденсируются в бесцветную жидкость со жгучим вкусом. В средние века спирт считался одним из сильнейших лекарственных средств, одно из первых его названий - aqua vitae- «жизненная вода» [3].
Благодаря научным достижениям XIX —XX вв. стало возможным глобальное использование спиртов. Ученые прошлого разработали теорию строения водно-спиртовых растворов, исследовали их физико-химические свойства. Открыли способы брожения: циклический и непрерывно-проточный.
Значимые изобретения химической науки прошлого, которые сделали реальным полезное свойство спиртов:
Был открыт гомологический ряд спиртовых веществ. Проведены серии экспериментов по синтезу метанола, этиленгликоля. Передовые научные исследования второй половины XX века помогли улучшить качество производимой продукции. Подняли уровень российской спиртовой промышленности.
В настоящее время спирты применяютсяво многих сферах деятельности: медицине, косметологии, промышленности, это органические соединения стали незаменимым продуктом для человека.
Цель работы – охарактеризовать химические свойства, способы получения и применение спиртов.
Классификация спиртов
Спирты - это производные углеводородов, в которых один или несколько атомов водорода заменены на гидроксильные группы.
В зависимости от числа гидроксильных групп спирты подразделяются на одно-, двух-, трехатомные и т.д. Двухатомные спирты часто называют гликолями по названию простейшего представителя этой группы – этиленгликоля. Спирты, содержащие большее количество гидроксильных групп, обычно объединяют общим названием многоатомные спирты.
- Одноатомные CH3-OH метанол или метиловый спирт
- Двухатомные HO-CH2-CH2 -OH этандиол-1,2 или этиленгликоль
- Трехатомные HO-CH2-CH(OH)-CH2-OH пропантриол-1,2,3 или глицерин
В зависимости от характера углеводородного радикала спирты делятся на:
- Алифатические C2H5OH
- Алициклические 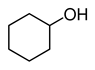
- Ароматические 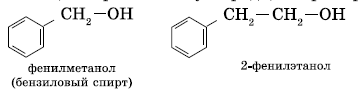
В зависимости от того, при каком атоме углерода находится гидроксильная группа, различают:
- Первичные спирты C2H5OH
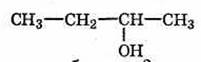 - Вторичные спирты
- Вторичные спирты
- Третичные спирты
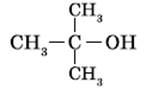 [4]
[4]
Строение и физические свойства спиртов
Наличие в молекуле спирта более отрицательного, по сравнению с углеродом и водородом, атома кислорода приводит к смещению электронной плотности в его сторону.
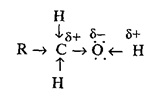
В результате атом кислорода приобретает частичный отрицательный заряд, а атомы углерода и водорода - частичные положительные заряды. Поэтому связи C-O и O-H полярны, из них наиболее полярна связь O-H из-за большей разницы в электроотрицательности. За счёт смещения электронной плотности атом водорода гидроксильной группы более подвижен, чем атомы водорода, и входящие в углеводородный радикал. Это приводит к появлению у спиртов слабых кислотных свойств. Пространственное строение молекулы предельного одноатомного спирта существенно не отличается от пространственного строения алканов, с той лишь разницей, что один из атомов водорода замещён на гидроксильную группу [5].
В результате полярности гидроксильной группы и наличия в ней электродефицитного атома водорода между молекулами спирта возникают особые межмолекулярные связи, называемые водородными. Наличие межмолекулярных водородных связей значительно сказывается на физических свойствах спиртов.
Во-первых, их молекулы сильнее ассоциированы между собой по сравнению, например, с углеводородами, поэтому в гомологических рядах спиртов нет газообразных веществ.
Во-вторых, водородные связи могут образовываться не только между молекулами спиртов, но и между молекулами спиртов и растворителя, например воды. Это обуславливает хорошую растворимость спиртов с небольшим углеводородным радикалом в воде. Водородные связи между молекулами спиртов и воды настолько сильны, что при смешении этих жидкостей уменьшается суммарный объём.
Согласно статистическим данным, на температуру кипения, плавления и плотность влияет не только размер и длина углеродной цепи, но и расположение, и количество гидроксильных групп. В целом спиртам присущи такие изменения:
1) С ростом углеродной цепи уменьшается температура плавления и повышается температура кипения с плотностью.
2) Связь гидроксильной группы со вторичным или третичным атомом понижает температуру плавления и увеличивает температуру кипения, плотность уменьшается.
3) С увеличением количества гидроксильных групп повышается температура плавления, повышается температура кипения, увеличивается плотность [2].
Метанол, этанол и пропанол-1 имеют специфический алкогольный запах, другие жидкие спирты обладают удушливым, неприятным запахом. Высшие спирты запаха не имеют.