Спирты-вещества нейтральные, но в незначительной степени они проявляют амфотерные свойства.
- Реакции с разрывом связи О-Н
1) При взаимодействии спиртов с щелочными металлами водород гидроксила замещается металлом с образованием алкоголятов:
2С2H5OH+2Na=2C2H5ONa+H2
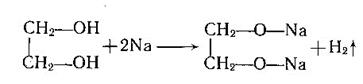
Алкоголяты легко растворяются водой:
C2H5ONa+H2O=C2H5OH+NaOH
так как спирты более слабые кислоты, чем вода.
Кислотные свойства спиртов убывают в следующем порядке: первичные, вторичные, третичные.
2) Реакция этерификации. При действии на спирты минеральных и органических кислот образуются сложные эфиры
C2H5OH + HOSO3H → C2H5OSO3H + H2O (этилгидросульфат)
C2H5OH + СH3COOH → CH3COOC2H5 + H2O (этиловый эфир уксусной кислоты или этилацетат)
Отличительной особенностью второй реакции, является, то, что атом водорода отщепляется от спирта, а группа ОН от молекулы кислоты. Это было установлено экспериментально методом «меченых атомов» [3].
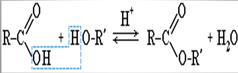
Реакция образования сложных эфиров минеральных и органических кислот обратима: на определённой стадии наступает равновесие. Скорость образования сложных эфиров, как показал Н.А. Меншуткин, при одной и той же кислоте для первичных спиртов примерно в два раза выше, чем для вторичных, и в 20 раз больше чем для третичных [5].
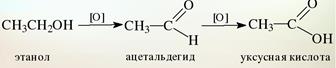
3. Реакции окисления. Спирты окисляются под действием дихромата или перманганата калия до карбонильных соединений.
Первичные спирты окисляются в альдегиды, которые в свою очередь, могут окисляются до карбоновых кислот.
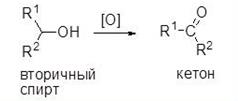
Вторичные спирты окисляются в кетоны:
Третичные спирты могут окисляться только с разрывом С-С связей.
- Реакции с разрывом связи С-О
1) Реакции дегидратации протекают при нагревании спиртов с водоотнимающими веществами. Водоотнимающими веществами являются кислоты (H2SO4,H3PO4,щавелевая, бензосульфокислота и др.),оксиды (алюминия, тория и др.),некоторые соли (гидросульфат калия, сульфат меди, хлорид цинка и др.)
а) при низких температурах (меньше 140 градусов) происходит межмолекулярная дегидратация с образованием простых эфиров
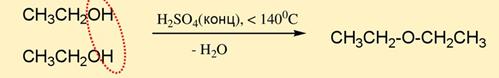
б) при сильном нагревании происходит внутримолекулярная дегидратация с образованием алкенов
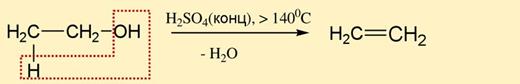
2) Спирты обратимо реагируют с галогенводородными кислотами по механизму нуклеофильного замещения (SN):
R-OH + HCl = R-Cl+H2O
Поэтому её проводят в присутствии водоотнимающих веществ. Третичные спирты вступают в реакцию гораздо проще вторичных, вторичные проще первичных. Это объясняется электроноотталкивающим действием алкильных групп и большей устойчивостью образующегося катиона. Реакцию галогеноводорода со спиртами часто проводят так, что галогенводород образуется непосредственно в реакционной среде, например при нагревании спирта с бромидом натрия и серной кислотой:
C2H5OH+NaBr+H2SO4=C2H5Br+NaHSO4+H2O
Спирты можно превратить в галогенпроизводные действием галогенидов фосфора (V) и фосфора (III), а также тионилхлорида SOCl2:
3R-OH + PCl3 → 3R-Cl + H3PO3
C2H5-OH + PCl5 → C2H5Cl + POCl3 + HCl
C2H5 OH + SOCl2 + → C2H5Cl + SO2 + HC1
Многоатомные спирты более сильные кислоты, чем одноатомные спирты. Поэтому они могут реагировать с щелочами, образуя соли [1].
Качественной реакцией на многоатомные спирты, содержащие группы ОН при соседних атомах углерода, является ярко синее окрашивание при действии свежеосажденного гидроксида меди (II). Цвет раствора обусловлен образованием комплексного гликолята меди
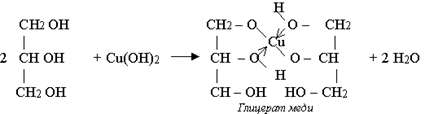
Получение спиртов
Исходными соединениями для получения спиртов служат непредельные углеводороды, галогенпроизводные, альдегиды и кетоны:
1) Гидратация алкенов. Это один из наиболее важных промышленных способов получения спиртов. Реакция идет в присутствии кислотного катализатора.
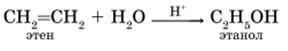
2) Гидролиз алкилгалогенидов под действием водных растворов щелочей.
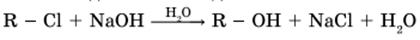
По этой реакции можно получать первичные, вторичные и третичные спирты.
3) Восстановление альдегидов и кетонов. При восстановлении альдегидов образуются первичные спирты, при восстановлении кетонов – вторичные спирты.
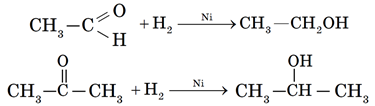
Реакцию проводят, пропуская смесь паров альдегида или кетона и водорода над никелевым катализатором.
4) Действием реактивов Гриньяра на карбонильные соединения.
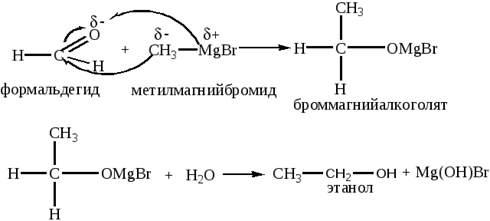
5) Этанол получают спиртовым брожением глюкозы
C6H12O6 → 2C2H5OH+2CO2
6) Метанол получают из оксида водорода и водорода в присутствии, например, цинк-хромового катализатора при температуре и давлении
CO + 2 H2 → CH3OH