Скоростью химической реакции называется ИЗМЕНЕНИЕ КОНЦЕНТРАЦИИ реагента или продукта в единицу времени.
Разницу между тем, что было и тем, что стало, часто обозначают буквой греческого алфавита Δ (дельта) Следовательно, только что приведенное определение математически можно выразить так:
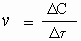
где v - скорость реакции, ΔC - изменение концентрации (в моль/л), а Δτ - интервал времени, в течение которого это изменение произошло (сек). Следовательно, размерность у скорости реакции такая: "моль/л · сек".
Факторы, влияющие на скорость химической реакции-
Реакция происходит при столкновении молекул реагирующих веществ, её скорость определяется количеством столкновений и их силой (энергией)
Природа реагирующих веществ, концентрация, давление, температура, площадь соприкосновения, катализатор, ингибитор
Природа реагирующих веществ
Реакционная активность веществ определяется:
l характером химических связей
v скорость больше у веществ с ионной и ковалентной полярной связью (неорганические вещества)
v скорость меньше у веществ с ковалентной малополярной и неполярной связью (органические вещества)
υ(Zn + HCl = H2 + ZnCl2) > υ(Zn + CH3COOH = H2 + Zn(CH3COO)2
l их строением
v скорость больше у металлов, которые легче отдают электроны (с большим радиусом атома)
v скорость больше у неметаллов, которые легче принимают электроны (с меньшим радиусом атома)
υ(2K + 2H2O = H2 + 2KOH) > υ(2Na + 2H2O = H2 + 2NaOH)
Концентрация
Для взаимодействия веществ их молекулы должны столкнуться. Число столкновений пропорционально числу частиц реагирующих веществ в единице объёма, т.е. их молярным концентрациям.
1867 г. К.Гульдберг и П.Вааге сформулировали закон действующих масс
Закон действующих масс:
Скорость элементарной химической реакции пропорциональна произведению молярных концентраций реагирующих веществ, возведённых в степени равные их коэффициентам:
a A + bB ® dD + fF
v = k · c (A)a · c (B)b
k - константа скорости реакции
(v = k при c (A) = c (B) = 1 моль/л)
Температура
Объяснение зависимости скорости реакции от температуры было дано С.Аррениусом. К реакции приводит не каждое столкновение молекул реагентов, а только наиболее сильные столкновения. Лишь молекулы, обладающие избытком кинетической энергии, способны к химической реакции.
С.Аррениус рассчитал долю активных (т.е. приводящих к реакции) соударений реагирующих частиц, зависящую от температуры.
v молекула - энергетически выгодное образование
v химические вещества на энергетической диаграмме занимают положение в "ямках"
v для превращения этих веществ в другие, им надо сообщить энергию, достаточную для того, чтобы они выбрались из "ямки", перевалили через "барьер" (энергию активации)
Энергия активации
Активация – процесс превращения неактивных частиц в активные для преодоления энергетического барьера
Энергия, которую надо сообщить частицам реагирующих веществ, чтобы превратить их в активные, называют энергией активации (Еа)
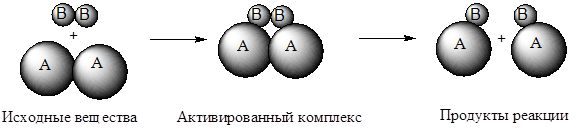
A2 (г) + B2 (г) = 2AB (г)
В газе при нормальных условиях каждая из молекул
испытывает 1010 столкновений в секунду.
Например, среднее время между двумя соударениями в Н2 всего 5·10-9 с.
Если бы все столкновения приводили к реакции,
то любая реакция между газами происходила бы мгновенно!
Температура повышает количество столкновений молекул. Правило Вант-Гоффа (сформулировано на основании экспериментального изучения реакций) В интервале температур от 0°С до 100°С при повышении температуры на каждые 10 градусов скорость химической реакции возрастает в 2-4 раза:
v = v0·g∆τ/10
g - температурный коэффициент Вант-Гоффа
Правило Вант-Гоффа не имеет силу закона. Лабораторная техника была несовершенна, поэтому:
v оказалось, что температурный коэффициент в значительном температурном интервале непостоянен
v невозможно было изучать как очень быстрые реакции (протекающие за миллисекунды), так и очень медленные (для которых требуются тысячи лет)
v реакции с участием больших молекул сложной формы (например, белков) не подчиняются правилу Вант-Гоффа
Катализаторы
Катализаторы- вещества, изменяющие скорость химической реакции за счёт изменения энергии активации, но сами при этом не расходующиеся. Процесс в присутствии катализатора – катализ. Реакция с катализатором – каталитическая.
Положительные катализаторы – ускоряют реакцию, уменьшая Еа
Отрицательные катализаторы (ингибиторы) – замедляют реакцию, увеличивая Еа
A + K = AK (1)
AK + B = AB + K (2)
Суммарная реакция
A + B = AB
Но вместо энергетического барьера этой реакции преодолеваются более низкие барьеры реакций (1) и (2): E1 и E2
Йенс Якоб Берцелиус ввел термин «катализ » в 1835 г.
Вильгельм Оствальд 1909 г. – Нобелевская премия «в признание работ по катализу»