
Т. гондий представляет собой сложный эукариотический организм с несколькими белками поверхностных, а также цитоплазматических антигенов, которые могут вызывать воспалительную реакцию хозяина. Роль специфических антигенов токсоплазмы в индукции врожденной реакции лишь частично поняты. Поверхность Т. гондий содержит семейство онтогенетически регулируется glycosylphos-phatidylinositol (GPI) -связанных белки (SRSS), из которых поверхностного антиген 1 (SAG1) является членом прототипным. SAG1 белок экспрессируется исключительно на тахизоит. Биологическая роль этого superfam-Ily поверхностных белков остается в основном загадочной, хотя есть доказательства роли в привязанности паразита. SAG1 индуцирует доминирующую реакцию антител при инфекции, а также сильный, системный Th1-типа Т-клеточный ответ, характеризующийся высоким титром ИФНγ производство по CD4 и CD8 Т-лимфоцитов.
SAG1 нуля-мутант был спроектирован homolo-рекомбинацией, и Гусь использовал для инфицирования мышея C57BL / 6. Этот мутант был показан в пробирке придерживаться и репликации в фибробластах на том же или даже в лучшей степени, чем в контрольном родительском штамме. В естественных условиях, мы смогли показать, что этот антиген-дефицитного паразит не может индуцировать илеит последующей Инг intralumenal инфекции. Хотя этот мутант
может реплицировать как в хосте, и в пробирке культуре клеток, инфекция связана с уменьшением как врожденной и адаптивной воспалительных иммунных реакций.
Мы исследовали способность этого антигена с дефицитом паразита, чтобы вызвать смертельный кишечный воспалительную реакцию у восприимчивых мышей. C57BL / 6 мышей перорально инфицированныхΔпровисают 1 паразиты не удалось разработать летальный илеит. В пробирке, мутантные паразиты реплицируются в обоих энтероцитов и дендритные клетки. В естественных условиях, заражение мутантных паразитов было связано со снижением производства обоих хемокинов и цитокинов в течение нескольких отсеков связанной с кишечником популяции клеток, в том числе энтероцитов, дендритные клетки и CD4+Т-клетки, выделенные из собственной пластинки. КГР-дефицитных (КГР-/-) мышей устойчивы к развитию летального илеита после перорального заражения паразита. Приемная передача антиген-специфические CD4+ эффекторные Т-лимфоциты, выделенные из C57BL / 6 мышей, зараженных в КГР-/-Мышей присвоил восприимчивость к развитию заболевания кишечника. В отличие от этого, CD4+ эффекторных Т-лимфоцитов происходит от мышей, инфицированных мутантного штамма Δsag1 не удалось передать патологию. Кроме того, устойчивы мышей (BALB / с), что не развивается летальный илеит после перорального инфицирования T.gondii были вынесены восприимчивы после интраназального предварительной сенсибилизации с SAG1 очищенного белка. Этот процесс был связан со сдвигом в сторону ответа Th1, как показано увеличением производства IFN-γ но не IL-10 или TGF-βв кишечнике этих мышей. Эти находят-ь демонстрирует, что один микробный антиген (SAG1) Т. гондия может вызвать летальный воспалительный процесс в экспериментальной модели патогена управляемой илеит (Rachinel и др., 2004).
ВЫВОДЫ

Развитие Т. гондии-специфических Th1 клеток в отсутствии IL-12 способствует концепции, что сигналы на вход и не зависят от производства IL-12 являются критическими для микробного-индуцированного Th1 выбора эффекторного.
Каковы другие сигналы, с помощью которого мог бы способствовать РС выбора подмножества Th1? Встреча

| Врожденный иммунитет В токсоплазме ИНФЕКЦИИ | ||
| Микробы или продукты их с контроллерами домена может привести к | Какими бы ни были сигналы и дорожки используются для сдвига | |
| повышающая регуляция главного комплекса гистосовместимости | иммунный ответ, Th1-типа иммунного ответа | |
| (МНС) ко-стимулирующих молекул класса II, а также | является абсолютно необходимым для борьбы с паразитами replica- | |
| (Например, CD40), которые вместе должны привести к APC-T-клетки | Тион. Если оставить Немодулированное, это Th1 типа иммунного | |
| взаимодействие на высоком уровне сигнала силы зывалась | реакция может привести к летальному повреждению хозяина, таким, как | |
| ously показано, что связано с Th1 поляризации. | илеит видели в C57BL / 6 мышей (рис 22.1). | |
| Врожденный ответ | Адаптивный ответ | |
| Паразиты |


 НЕТ
НЕТ






 (2)
(2) 







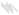






























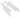




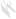


















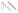






| (1) | ИЭЛ | (7) DC | |||
| ИЭЛ | (10) | ||||
| Chemokines | |||||
| Цитокины | (9) | ||||
| ПМН | ТФР-б IL-10, | ||||
| В | |||||
| (3) | |||||
| CD4 | (6) | ||||
| ИФН-г | |||||
| IL-15 | IL-12 | ||||
| НК, НКТ (8) | MF | ОКРУГ КОЛУМБИЯ | ||
| ИФН-г | (5) | |||
| (4) | ||||
РИСУНОК 22,1 Предложена модель Г.И. слизистой иммунной реакции на токсоплазм. Когда паразиты проникают в слизистую оболочку кишечника эпителий они впервые сталкиваются физический барьер, образованный энтероцитов связаны друг с другом с плотными соединениями (1). Паразиты разработали несколько стратегий придерживаться, иногда вторгаются в энтероцитах и распространиться за пределами эпителия. Когда энтероциты заражены паразитами, физио-логический и морфологические нарушения происходят и энтероциты, возможно, секретируют цитотоксические молекулы, такие как оксид азота (NO), (2). Кроме того, энтероцитов реагировать на инфекции путем секреции хемокинов и цитокинов, которые привлекают полиморфноядерных лейкоцитов (ПЯЛ) (3), макрофаги МΦ(4), и дендритные клетки (ДК) (5). При стимуляции, эти клетки врожденной иммунной системы могут быть непосредственно Бактерицидными. Они также являются источником цитокинов, таких как IL-12, который вызывает адаптивный иммунный ответ CD4 (6). Для того, чтобы быть выявлены, специфический иммунный ответ нуждается в презентации антигена, в основном через ГЦ. ДК образец антигена различными путями; один из них является прямым захватом антигена в просвет пути удлинения дендритов через плотные соединения (7). Активированный Т-клетки, в дополнение к NK и NKT клеток (8), стимулированных цитокинов, продуцируемых инфицированными эритроцитами, таких как IL-15, IFN- секретируютγ, Который активирует МΦ, контроллеры домена и энтероцитов для оформления паразита. В-клетки (9), также срабатывает секретируют антитела, которые могут проникать через эпителиальный барьер путем активного transcytose и достигают паразита в просвете. Помимо бактерицидной деятельности, IFN-γ,,если не контролируется, может привести к повреждению целостности кишечника. Внутриэпителиальные лимфоциты (IEL) (10) являются цито-токсичны для инфицированных энтероцитов и может привести к TGF-β, Что ограничивает IFN-γ производство.
Эта цифра воспроизводится в цвете в разделе Цвет пластины.