09.11.2021
Тема «Реакции ионного обмена и условия их протекания»
Цель урока: сформировать знания о реакциях ионного обмена, протекающих с образованием конечного продукта; сформировать умения составления полного и сокращенного ионного уравнений на основе молекулярного; выяснить условия протекания реакций ионного обмена.
Актуализация опорных знаний.
На предыдущих уроках вы изучили теорию электролитической диссоциации. Повторим основные понятия этой темы.
Задание № 1. «Закончите предложение, одним словом».
1. Положительно заряженные частицы -….
2. Отрицательно заряженные частицы -….
3. Вещества, водные растворы или расплавы которых проводят электрический ток -….
4. Вещества, водные растворы или расплавы которых не проводят электрический ток -...
5. Процесс распада электролита на ионы при растворении или расплавлении вещества -...
6. Электролиты, в водных растворах которых в качестве катионов образуется только ионы водорода –…
7. Электролиты, в водных растворах которых в качестве антона образуется только гидроксид-ионы – …
8.Электролиты, в водных растворах которых образуется катионы металла и анионы кислотного остатка –.
Задание № 2 «Куча мала». Ca2+;K+;CI-;Mg2+;SO42-;CO32-;Fe3+;OH-
Разложите их по двум папкам с названием «КАТИОНЫ» и «АНИОНЫ».
Мотивация учебной деятельности учащихся.
Растворимые в воде кислоты, соли и основания, являющиеся электролитами – это сложные вещества. Поскольку растворы электролитов, особенно сильных, большей частью состоят из ионов, значит, реакции обмена происходят между какими частицами - ионами.
Изучение нового материала
Реакции ионного обмена – это реакции, протекающие между ионами в растворах электролитов (Запись определения в тетрадь).
Реакции ионного обмена в растворах электролитов протекают только в том случае, если в результате взаимодействия между ионами образуется малорастворимые, газообразные либо малодиссоциирующие вещества (вода или другие слабые электролиты).
Рассмотрим примеры таких процессов - видеоматериал.
Классификация реакций ионного обмена.
а) с выпадением осадка;BaCl2 + H2SO4 = BaSO4 + 2HCl (молекулярное уравнение)
Ba2++2Cl-+ 2Н ++SO42-=BaSO4+2Н ++2Cl- (полное ионное уравнение)
Ba2+ + SO42- = BaSO4 (сокращенное ионное уравнение)
б) с выделением газа;Na2CO3+H2SO4=Na2SO4+H2O+CO2 (молекулярное уравнение)
2Na++CO32- +2H++SO42-=2Na++SO42-+H2O+CO2 (полное ионное уравнение)
2H+ + CO32- = H2O+CO2(сокращенное ионное уравнение)
в) с образованием малодиссоциируемого вещества (к примеру, молекулы воды).
2 NaOH + H2SO4= Na2SO4 + 2 H2O (молекулярное уравнение)
2Na++2OH-+2H++SO42- =2Na+ +SO42-+2H2O (полное ионное уравнение)
2H+ +2ОH- = 2H2O(сокращенное ионное уравнение)
Алгоритм составления реакций ионного обмена (РИО) в молекулярном, полном и кратком ионном виде
Алгоритм составления уравнений реакций ионного обмена:
1) Записывают уравнение в молекулярном виде и расставляют коэффициенты:

2) Записывают уравнение в ионном виде.
Для этого необходимо посмотреть в таблицу растворимости. Если вещество растворимо — его записывают в виде ионов (на пересечение которых смотрели, чтобы определить растворимо ли вещество). Если вещество нерастворимо — записывают в молекулярном виде:
Хлорид бария — растворим, значит записываем его в виде ионов бария и хлора. При этом необходимо помнить о коэффициентах и индексах (BaCl2 состоит из бария и 2-х хлоров, поэтому индекс «2» мы будем ставить перед анионами хлора):
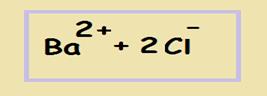
Смотрим на растворимость серной кислоты — растворима, записываем в виде протонов водорода и сульфат-анионов (т.к. в серной кислоте 2 атома водорода — значит, при её диссоциации образуется 2 протона):
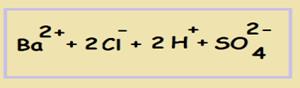
Далее переходим к продуктам реакции и снова смотрим, растворимы ли они. Сульфат бария — не растворим, значит, его мы записываем в молекулярном виде:

Соляная кислота: растворима, записываем в виде ионов. Т.к. перед формулой стоит коэффициент «2» — мы ставим его и перед ионами:

уравнение в ионном виде.
3) Составляем уравнение в сокращённом ионном виде. Для этого мы вычёркиваем те ионы, которые повторяются слева и справа (т.е. не участвуют в реакции):

Оставшиеся частицы переписываем. Это и будет сокращённым ионным уравнением:

В результате взаимодействия катионов бария с сульфат-анионами образуется нерастворимое в воде соединение — сульфат бария (осадок белого цвета)
Домашнее задание
Записать уравнения реакции в молекулярном и ионном виде:
А) Na2CO3+ H2SO4= Na2SO4+ CO2+ H2O
Б) NaOH + FeCl3 = Fe(OH)3 + NaCl
В) СаСО3 + HCl = CaCl2 + H2O + CO2