При образовании молекул из атомов внешние атомные орбитали перестраиваются, изменяются их энергетические уровни, образуются молекулярные орбитали. При этом считается для упрощения, что внутренние электроны атомов и внешние электроны, не участвующие в образовании связей, сохраняют ту же энергию, что и в индивидуальном атоме.
В зависимости от характера исходных атомных орбиталей, т.е. от того, какие атомы участвуют в образовании молекулы, могут образовываться молекулярные орбитали σ - и π -типа. σ -связями называют связи, которые имеют цилиндрическую симметрию относительно линии, соединяющей атомы. π -связи—это связи, симметричные относительно плоскости, проходящей через линию, соединяющую центры атомов.
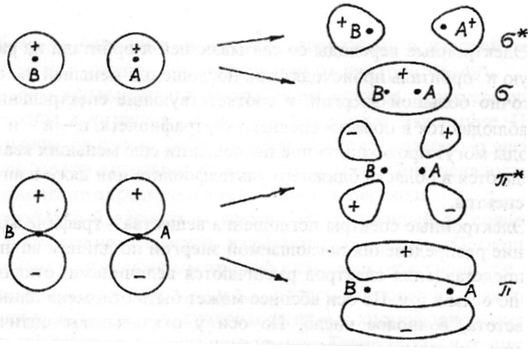
σ*- разрыхляющая
σ - связующая
π* - разрыхляющая
π - связующая
При отсутствии внешнего воздействия максимум электронной плотности в σ- и в π-связях находится между ядрами, стягивая их. Такие орбитали называются связывающими.
Орбитали, не принимающие участия в образовании связей, например, образованные неспаренными электронами азота, кислорода и др., т. наз. n-электронами, называются несвязывающимися n-орбиталями.
При некоторых условиях, например при воздействии электромагнитного излучения, конфигурация молекулярных орбиталей может измениться - максимум электронной плотности сместится к наружной стороне ядер, увеличивая отталкивание между ними. Образуются т. н. разрыхляющие орбитали, которые обозначаются σ* и π*.
Таким образом, при поглощении электромагнитного излучения УФ- и видимого диапазона могут происходить электронные переходы со связывающих σ- и π -орбиталей и несвязывающих n-орбиталей на разрыхляющие σ* - и π* -орбитали. Относительные энергии молекулярных орбиталей разных типов представлены на рис. Из этой диаграммы видно, что наибольшую разность энергий имеют σ - и σ*-орбитали. Вследствие этого σ – σ* переход может произойти при поглощении веществом излучения с относительно высокой (в пределах рассматриваемого диапазона) энергией и, соответственно, в спектре поглощения полоса поглощения будет наблюдаться в коротковолновой (дальний УФ) области.
Электронные переходы со связывающей π-орбитали на разрыхляющую π* -орбиталь происходят при поглощении меньшей, но все же достаточно большой энергии, и соответствующие спектральные линии наблюдаются в области среднего ультрафиолета. n-π* и n - σ* переходы могут происходить при поглощении еще меньших квантов и наблюдаются в области ближнего ультрафиолета или даже в видимой части спектра.
Электронные спектры поглощения вещества - графическое изображение распределения поглощаемой энергии по длинам волн. Способы представления спектров различаются величинами, откладываемыми по осям х и у. По оси абсцисс может быть отложена длина волны, частота, волновое число. По оси у откладывают оптическую плотность, логарифм оптической плотности, пропускание. Выбор системы координат определяется задачами анализа, исследуемой областью спектра и др. Вид спектров, изображенных в разных системах координат, отличается.

Т. к. поглощаемая энергия приводит к изменению не только электронного, но и колебательного, и вращательного состояний поглощающих молекул, наблюдаемые спектры поглощения представляют собой широкие полосы с одним или несколькими максимумами в непрерывной области поглощения или несколькими максимумами в различных областях, разделенных областями пропускания.
Полосы поглощения в электронном спектре характеризуются длиной волны и интенсивностью, измеряемыми в максимуме. Положение полосы на шкале длин волн определяется разностью энергий состояний, между которыми происходит переход. Интенсивность полосы поглощения определяется вероятностью перехода.