Азот — характеристика элемента, физические и химические свойства простого вещества. Аммиак, соли аммония.

Азот (N) находится во втором периоде, пятой группе главной подгруппы. Порядковый номер – 7, Ar – 14,008.
Молекула N2 – самая прочная из всех двухатомных за счет наличия тройной связи малой длины (энергия связи – 946 кДж). Связь в молекуле ковалентная неполярная.
Физические свойства: бесцветный газ, без запаха и вкуса; малорастворим в воде: в 1 л H2O растворяется 15,4 мл N2 при t° = 20 °C и p = 1 атм; t кипения =-196 °C; t плавления =-210 °C. Природный азот состоит из двух изотопов с атомными массами: 14 и 15.
Химические свойства азота: Атом азота имеет 7 электронов, из них 5 на внешнем уровне (5 валентных электронов). Он является одним из самых электроотрицательных элементов (3,04 по шкале Полинга), уступая лишь хлору (3.16), кислороду (3,44) и фтору (3,98).
Характерная валентность – 3 и 4.
Наиболее характерные степени окисления: -3, -2, -1, +2, +3, +4, +5, 0. В обычных условиях азот подобен инертному газу.
В обычных условиях азот непосредственно взаимодействует лишь с литием с образованием Li3N. При нагревании (то есть активации молекул N2) или воздействии электрического разряда вступает в реакцию со многими веществами, обычно выступает как окислитель (азот по электроотрицательности на 3 месте после кислорода и фтора) и лишь при взаимодействии со фтором и кислородом – как восстановитель.
N2 + 3H2 ↔ 2NH3
N2 + 2B → 2BN
3Si + 2N2 → Si3N4
3Ca + N2 → Ca3N2
N2 + O2 → 2NO.
Получение азота. В промышленности азот получают путем сжижения воздуха с последующим испарением и отделением азота от других газовых фракций воздуха (перегонка). Полученный азот содержит примеси благородных газов (аргона).
В лабораториях обычно используется азот, доставляемый с производства в стальных баллонах под повышенным давлением или жидкий азот в сосудах Дьюара. Можно получать азот разложением некоторых его соединений:
NH4NO2 → N2 + 2H2O (при to)
(NH4)2Cr2O7 → N2 + Cr2O3 + 4H2O (при to)
2N2O → 2N2 + O2 (при to)
Особо чистый азот получают термическим разложением азида натрия:
2NaN3 → 2Na + 3N2 (при to)
Нахождение в природе: в природе азот встречается в основном в свободном состоянии. Содержание азота в воздухе — его объемная доля 78,09 %. В небольшом количество соединения азота находится в почве; азот входит в состав аминокислот, образующих через посредство пептидных связей белки; содержится в молекулах нуклеиновых кислот – ДНК и РНК – в составе азотистых оснований (нуклеотидов): гуанина, аденила, тимидила, цитизила и уридила. Общее содержание азота в земной коре – 0,01 %. Из минералов промышленное значение имеют чилийская селитра NaNO3 и индийская селитра KNO3.
Азот и его соединения
Азот — элемент 2-го периода V А-группы Периодической системы, порядковый номер 7. Электронная формула атома [2He]2s22p3, характерные степени окисления 0,-3, +3 и +5, реже +2 и +4 и др. состояние Nvсчитается относительно устойчивым.
Шкала степеней окисления у азота:
+5 — N2O5, NO3, NaNO3, AgNO3
+4 — NO2
+3 – N2O3, NO2, HNO2, NaNO2, NF3
+2 — NO
+1 – N2O
0 — N2
-3 — NH3, NH4, NH3 * H2O, NH2Cl, Li3N, Cl3N.
Азот обладает высокой электроотрицательностью (3,07), третий после F и O. Проявляет типичные неметаллические (кислотные) свойства, образуя при этом различные кислородсодержащие кислоты, соли и бинарные соединения, а так же катион аммония NH4 и его соли.
В природе – семнадцатый по химической распространенности элемент (девятый среди неметаллов). Жизненно важный элемент для всех организмов.
Азот N2
Простое вещество. Состоит из неполярных молекул с очень устойчивой ˚σππ-связью N≡N, этим объясняется химическая инертность элемента при обычных условиях.
Бесцветный газ без вкуса и запаха, конденсируется в бесцветную жидкость (в отличие от O2).
Главная составная часть воздуха 78,09% по объему, 75,52 по массе. Из жидкого воздуха азот выкипает раньше, чем кислород. Малорастворим в воде (15,4 мл/1 л H2O при 20 ˚C), растворимость азота меньше, чем у кислорода.
При комнатной температуре N2, реагирует с фтором и в очень малой степени – с кислородом:
N2 + 3F2 = 2NF3, N2 + O2 ↔ 2NO
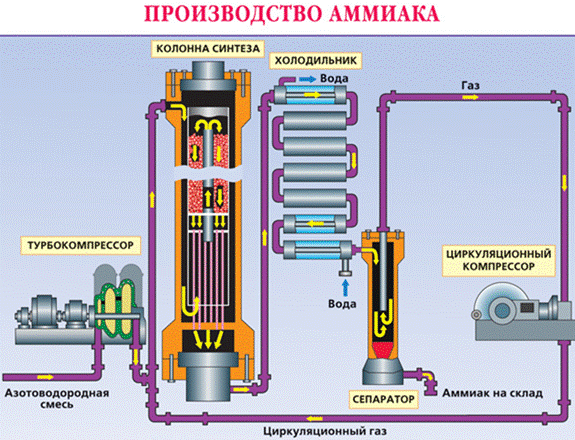
Обратимая реакция получения аммиака протекает при температуре 200˚C, под давлением до 350 атм и обязательно в присутствии катализатора (Fe, F2O3, FeO, в лаборатории при Pt)
N2 + 3H2 ↔ 2NH3 + 92 кДж
В соответствии с принципом Ле-Шателье увеличение выхода аммиака должно происходить при повышении давления и понижении температуры. Однако скорость реакции при низких температурах очень мала, поэтому процесс ведут при 450-500 ˚C, достигая 15%-ного выхода аммиака. Непрориагировавшие N2 и H2 возвращают в реактор и тем самым увеличивают степень протекания реакции.
Азот химически пассивен по отношению к кислотам и щелочам, не поддерживает горения.
Получение в промышленности – фракционная дистилляция жидкого воздуха или удаление из воздуха кислорода химическим путем, например по реакции 2C(кокс) + O2 = 2CO при нагревании. В этих случаях получают азот, содержащий так же примеси благородных газов (главным образом аргон).
В лаборатории небольшие количества химически чистого азота можно получить по реакции конмутации при умеренном нагревании:
N-3H4N3O2(T) = N20 + 2H2O (60-70)
NH4Cl(p) + KNO2(p) = N20↑ + KCl +2H2O (100˚C)
Применяется для синтеза аммиака. Азотной кислоты и других азотсодержащих продуктов, как инертная среда проведения химических и металлургических процессов и хранения огнеопасных веществ.
Аммиак NH3
Бинарное соединение, степень окисления азота равна – 3. Бесцветный газ с резким характерным запахом. Молекула имеет строение незавершенного тетраэдра [: N(H)3] (sp3-гибридизация). Наличие у азота в молекуле NH3 донорской пары электронов на sp3-гибридной орбитали обуславливает характерную реакцию присоединения катиона водорода, при этом образуется катион аммония NH4. Сжижается под избыточным давлением при комнатной температуре. В жидком состоянии ассоциирован за счет водородных связей. Термически неустойчив. Хорошо растворим в воде (более 700 л/1 л H2O при 20˚C); доля в насыщенном растворе равна 34% по массе и 99% по объему, pH= 11,8.
Весьма реакционноспособный, склонен к реакциям присоединения. Сгорает в кислороде, реагирует с кислотами. Проявляет восстановительные (за счет N-3) и окислительные (за счет H+1) свойства. Осушается только оксидом кальция.
Качественные реакции – образование белого «дыма» при контакте с газообразным HCl, почернение бумажки, смоченной раствором Hg2(NO3)2.
Промежуточный продукт при синтезе HNO3 и солей аммония. Применяется в производстве соды, азотных удобрений, красителей, взрывчатых веществ; жидкий аммиак – хладагент. Ядовит.
Уравнения важнейших реакций:
2NH3(г) ↔ N2 + 3H2
NH3(г) + H2O ↔ NH3 * H2O (р)↔ NH4++ OH—
нашатырный спирт (3-15%), аммиачная вода (25%)
NH3(г) + HCl(г) ↔ NH4Cl(г) белый «дым» нашатырь
4NH3 + 3O2 (воздух) = 2N2 + 6 H2O (сгорание)
4NH3 + 5O2 = 4NO+ 6 H2O (800˚C, кат. Pt/Rh)
2 NH3 + 3CuO = 3Cu + N2 + 3 H2O (500˚C)
2 NH3 + 3Mg = Mg3N2 +3 H2 (600 ˚C)
NH3(г) + CO2(г) + H2O = NH4HCO3 (комнатная температура, давление)
Получение. В лаборатории – вытеснение аммиака из солей аммония при нагревании с натронной известью: Ca(OH)2 + 2NH4Cl = CaCl2+ 2H2O +NH3
Или кипячение водного раствора аммиака с последующим осушением газа.
В промышленности аммиак получают из азота с водородом. Выпускается промышленностью либо в сжиженном виде, либо в виде концентрированного водного раствора под техническим названием аммиачная вода.
Гидрат аммиака NH3 *H2O. Межмолекулярное соединение. Белый, в кристаллической решетке – молекулы NH3 и H2O, связанные слабой водородной связью. Присутствует в водном растворе аммиака, слабое основание (продукты диссоциации – катион NH4 и анион OH). Катион аммония имеет правильно-тетраэдрическое строение (sp3-гибридизация). Термически неустойчив, полностью разлагается при кипячении раствора. Нейтрализуется сильными кислотами. Проявляет восстановительные свойства (за счет N-3) в концентрированном растворе. Вступает в реакцию ионного обмена и комплексообразования.
Качественная реакция – образование белого «дыма» при контакте с газообразным HCl. Применяется для создания слабощелочной среды в растворе, при осаждении амфотерных гидроксидов.
В 1 М растворе аммиака содержится в основном гидрат NH3 *H2O и лишь 0,4% ионов NH4 OH (за счет диссоциации гидрата); таким образом, ионный «гидроксид аммония NH4 OH» практически не содержится в растворе, нет такого соединения и в твердом гидрате.
Уравнения важнейших реакций:
NH3 H2O (конц.) = NH3↑ + H2O (кипячение с NaOH)
NH3 H2O + HCl (разб.) = NH4Cl + H2O
3(NH3 H2O) (конц.) + CrCl3 = Cr(OH)3↓ + 3 NH4Cl
8(NH3 H2O) (конц.) + 3Br2(p) = N2↑ + 6 NH4Br + 8H2O (40-50˚C)
2(NH3 H2O) (конц.) + 2KMnO4 = N2↑ + 2MnO2↓ + 4H2O + 2KOH
4(NH3 H2O) (конц.) + Ag2O = 2[Ag(NH3)2]OH + 3H2O
4(NH3 H2O) (конц.) + Cu(OH)2 + [Cu(NH3)4](OH)2 + 4H2O
6(NH3 H2O) (конц.) + NiCl2 = [Ni(NH3)6]Cl2 + 6H2O
Разбавленный раствор аммиака (3-10%-ный) часто называют нашатырным спиртом (название придумано алхимиками), а концентрированный раствор (18,5 – 25%-ный) – аммиачный раствор (выпускается промышленностью).
Оксиды азота
Монооксид азота NO
Несолеобразующий оксид. Бесцветный газ. Радикал, содержит ковалентную σπ-связь (N꞊O), в твердом состоянии димер N2О2 со связью N-N. Чрезвычайно термически устойчив. Чувствителен к кислороду воздуха (буреет). Малорастворим в воде и не реагирует с ней. Химически пассивен по отношению к кислотам и щелочам. При нагревании реагирует с металлами и неметаллами. весьма реакционноспособная смесь NO и NO2 («нитрозные газы»). Промежуточный продукт в синтезе азотной кислоты.
Уравнения важнейших реакций:
2NO + O2(изб.) = 2NO2 (20˚C)
2NO + C(графит) = N2 + CО2 (400- 500˚C)
10NO + 4P(красный) = 5N2 + 2P2O5 (150- 200˚C)
2NO + 4Cu = N2 + 2 Cu2O (500- 600˚C)
Реакции на смеси NO и NO2:
NO + NO2 +H2O = 2HNO2(p)
NO + NO2 + 2KOH(разб.) = 2KNO2 + H2O
NO + NO2 + Na2CO3 = 2Na2NO2 + CО2 (450- 500˚C)
Получение в промышленности: окисление аммиака кислородом на катализаторе, в лаборатории — взаимодействие разбавленной азотной кислоты с восстановителями:
8HNO3 + 6Hg = 3Hg2(NO3)2 + 2 NO↑ + 4 H2O
или восстановлении нитратов:
2NaNO2 + 2H2SO4 + 2NaI = 2 NO↑ + I2↓ + 2 H2O + 2Na2SO4
Диоксид азота NO2
Кислотный оксид, условно отвечает двум кислотам — HNO2 и HNO3 (кислота для N4 не существует). Бурый газ, при комнатной температуре мономер NO2, на холоду жидкий бесцветный димер N2О4 (тетраоксид диазота). Полностью реагирует с водой, щелочами. Очень сильный окислитель, вызывает коррозию металлов. Применяется для синтеза азотной кислоты и безводных нитратов, как окислитель ракетного топлива, очиститель нефти от серы и катализатор окисления органических соединений. Ядовит.
Уравнение важнейших реакций:
2NO2 ↔ 2NO + O2
4NO2(ж) + H2O = 2HNO3 + N2О3 (син.) (на холоду)
3 NO2 + H2O = 3HNO3 + NO↑
2NO2 + 2NaOH(разб.) = NaNO2 + NaNO3 + H2O
4NO2 + O2+ 2 H2O = 4 HNO3
4NO2 + O2 + KOH = KNO3 + 2 H2O
2NO2 + 7H2 = 2NH3 + 4 H2O (кат. Pt, Ni)
NO2 + 2HI(p) = NO↑ + I2↓ + H2O
NO2 + H2O + SO2 = H2SO4 + NO↑ (50- 60˚C)
NO2 + K = KNO2
6NO2 + Bi(NO3)3 + 3NO (70- 110˚C)
Получение: в промышленности — окислением NO кислородом воздуха, в лаборатории – взаимодействие концентрированной азотной кислоты с восстановителями:
6HNO3 (конц.,гор.) + S = H2SO4 + 6NO2↑ + 2H2O
5HNO3 (конц.,гор.) + P (красный) = H3PO4 + 5NO2 ↑ + H2O
2HNO3 (конц.,гор.) + SO2 = H2SO4 + 2 NO2 ↑
Оксид диазота N2O
Бесцветный газ с приятным запахом («веселящий газ»), N꞊N꞊О, формальная степень окисления азота +1, плохо растворим в воде. Поддерживает горение графита и магния:
2N2O + C = CO2 + 2N2 (450˚C)
N2O + Mg = N2 + MgO (500˚C)
Получают термическим разложением нитрата аммония:
NH4NO3 = N2O + 2 H2O (195- 245˚C)
применяется в медицине, как анастезирующее средство.
Триоксид диазота N2O3
При низких температурах –синяя жидкость, ON꞊NO2, формальная степень окисления азота +3. При 20 ˚C на 90% разлагается на смесь бесцветного NO и бурого NO2 («нитрозные газы», промышленный дым – «лисий хвост»). N2O3 – кислотный оксид, на холоду с водой образует HNO2 , при нагревании реагирует иначе:
3N2O3 + H2O = 2HNO3 + 4NO↑
Со щелочами дает соли HNO2, например NaNO2.
Получают взаимодействием NO c O2 (4NO + 3O2 = 2N2O3) или с NO2 (NO2 + NO = N2O3)
при сильном охлаждении. «Нитрозные газы» и экологически опасны, действуют как катализаторы разрушения озонового слоя атмосферы.
Пентаоксид диазота N2O5
Бесцветное, твердое вещество, O2N – O – NO2, степень окисления азота равна +5. При комнатной температуре за 10 ч разлагается на NO2 и O2. Реагирует с водой и щелочами как кислотный оксид:
N2O5 + H2O = 2HNO3
N2O5 + 2NaOH = 2NaNO3 + H2
Получают дегидротацией дымящейся азотной кислоты:
2HNO3 + P2O5 = N2O5 + 2HPO3
или окислением NO2 озоном при -78˚C:
2NO2 + O3 = N2O5 + O2
Нитриты и нитраты
Нитрит калия KNO2. Белый, гигроскопичный. Плавится без разложения. Устойчив в сухом воздухе. Очень хорошо растворим в воде (образуя бесцветный раствор), гидролизуется по аниону. Типичный окислитель и восстановитель в кислотной среде, очень медленно реагирует в щелочной среде. Вступает в реакции ионного обмена. Качественные реакции на ион NO2— обесцвечивание фиолетового раствора MnO4 и появление черного осадка при добавлении ионов I. Применяется в производстве красителей, как аналитический реагент на аминокислоты и йодиды, компонент фотографических реактивов.
уравнение важнейших реакций:
2KNO2(т) + 2HNO3(конц.) = NO2↑ + NO↑ + H2O + 2KNO3
2KNO2 (разб.)+ O2(изб.) → 2KNO3 (60-80 ˚C)
KNO2 + H2O + Br2 = KNO3 + 2HBr
5NO2— + 6H+ + 2MnO4— (фиол.) = 5NO3— + 2Mn2+ (бц.) + 3H2O
3 NO2— + 8H+ + CrO72- = 3NO3— + 2Cr3+ + 4H2O
NO2—(насыщ.) + NH4+(насыщ.)= N2↑ + 2H2O
2NO2— + 4H+ + 2I—(бц.) = 2NO↑ + I2(черн.) ↓ = 2H2O
NO2—(разб.) + Ag+ = AgNO2 (светл.желт.)↓
Получение в промышленности – восстановлением калийной селитры в процессах:
KNO3 + Pb = KNO2 + PbO (350-400˚C)
KNO3 (конц.) + Pb(губка) + H2O = KNO2 + Pb(OH)2↓
3 KNO3 + CaO + SO2 = 2 KNO2 + CaSO4 (300 ˚C)
Hитрат калия KNO3
Техническое название калийная, или индийская соль, селитра. Белый, плавится без разложения при дальнейшем нагревании разлагается. Устойчив на воздухе. Хорошо растворим в воде (с высоким эндо -эффектом, = -36 кДж), гидролиза нет. Сильный окислитель при сплавлении (за счет выделения атомарного кислорода). В растворе восстанавливается только атомарным водородом (в кислотной среде до KNO2, в щелочной среде до NH3). Применяется в производстве стекла, как консервант пищевых продуктов, компонент пиротехнических смесей и минеральных удобрений.
2KNO3 = 2KNO2 + O2 (400- 500 ˚C)
KNO3 + 2H0 (Zn, разб. HCl) = KNO2 + H2O
KNO3 + 8H0 (Al, конц. KOH) = NH3↑ + 2H2O + KOH (80 ˚C)
KNO3 + NH4Cl = N2O↑ + 2H2O + KCl (230- 300 ˚C)
2 KNO3 + 3C (графит) + S = N2 + 3CO2 + K2S (сгорание)
KNO3 + Pb = KNO2 + PbO (350 — 400 ˚C)
KNO3 + 2KOH + MnO2 = K2MnO4 + KNO2 + H2O (350 — 400 ˚C)
Получение: в промышленности
4KOH (гор.) + 4NO2 + O2 = 4KNO3 + 2H2O
и в лаборатории:
KCl + AgNO3 = KNO3 + AgCl↓
Азотная кислота — строение и химические свойства

Азотная кислота – бесцветная гигроскопичная жидкость, c резким запахом, «дымит» на воздухе, неограниченно растворимая в воде.
tкип. = 83ºC.. При хранении на свету разлагается на оксид азота (IV), кислород и воду, приобретая желтоватый цвет:
4HNO3 = 4NO2 + 2H2O + O2.
Азотная кислота ядовита.
В растворе — сильная кислота; нейтрализуется щелочами, гидратом аммиака, реагирует с основными оксидами и гидроксидами, солями слабых кислот. Сильный окислитель; реагирует с металлами, неметаллами, типичными восстановителями. Концентрированная кислота пассивирует Al, Be, Bi, Со, Cr, Fe, Nb, Ni, Pb, Th, U; не реагирует с Au, Ir, Pt, Rh, Та, W, Zr. Не разрушает диоксид кремния. Смесь концентрированных HNO3 и HCl («царская водка») обладает сильным окислительным действием (превосходит чистую HNO3), переводит в раствор золото и платину. Еще более активна смесь концентрированных HNO3 и HF.
Mr = 63, 01; tпл = -41, 6 oC; tкип +82,6 oC 

Химические свойства азотной кислоты
1. Типичные свойства кислот:
1) Взаимодействует с основными и амфотерными оксидами:
2HNO3 + CuO = Cu(NO3)2 + H2O
6HNO3 + Al2O3 = 2Al(NO3)3 + 3H2O
2) С основаниями, амфотерными гидроксидами:
HNO3 + NaOH = NaNO3 + H2O
2HNO3 + Zn(OH)2 = Zn(NO3)2 + 2H2O
3) Вытесняет слабые кислоты из их солей:
2HNO3 + Na2CO3 = 2NaNO3 + H2O + CO2
2HNO3 + Na2SiO3 = H2SiO3 ↓+ 2NaNO3
2. Специфические свойства азотной кислоты как окислителя
1) Взаимодействие азотной кислоты с металлами
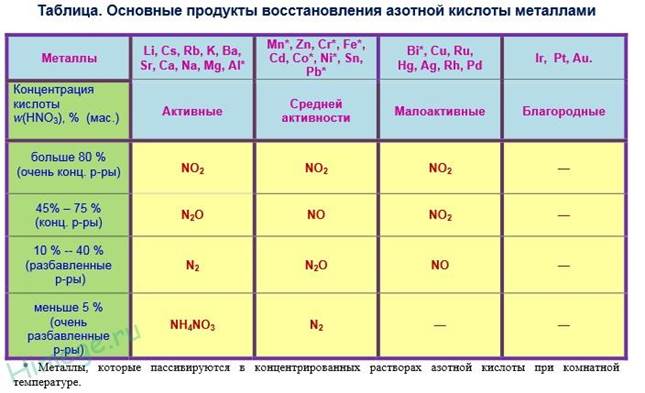
В качестве окислителя выступает азот в степени окисления +5, а не водород. В результате реакций образуется продукт восстановления нитрат-иона, соль и вода. Глубина восстановления нитрат-иона зависит от концентрации кислоты и от положения металла в электрохимическом ряду напряжений металлов. Возможные продукты взаимодействия металлов с азотной кислотой приведены в таблице ниже. Чем активнее металл и выше степень разбавления кислоты, тем глубже происходит восстановление нитрат-ионов азотной кислоты.


4 HN+5O3(конц.) + Cu0 = Cu+2(NO3)2 + 2 N+4O2 + 2 H2O
N+5 + 1e → N+4 2 окислитель, пр-с восстановления
Cu0 – 2e → Cu+2 1 восстановитель, пр-с окисления
8 HN+5O3(разб.) + 3 Cu0 = 3 Cu+2(NO3)2 + 2 N+2O + 4 H2O
N+5 + 3e → N+2 2 окислитель, пр-с восстановления
Cu0 – 2e → Cu+2 3 восстановитель, пр-с окисления
2) Проявляет окислительные свойства при взаимодействии с неметаллами:
S + 6HNO3(конц) = H2SO4 + 6NO2 + 2H2O;
B + 3HNO3 = H3BO3 + 3NO2;
3P + 5HNO3 + 2H2O = 5NO + 3H3PO4.
3) Азотная кислота окисляет сложные вещества:
6HI + 2HNO3 = 3I2 + 2NO + 4H2O;
FeS + 12HNO3 = Fe(NO3)3 + H2SO4 + 9NO2 + 5H2O.
4) Ксантопротеиновая реакция:
Азотная кислота окрашивает белки в оранжево-желтый цвет (при попадании на кожу рук – «ксантопротеиновая реакция»).
Реакцию проводят для обнаружения белков, содержащих в своем составе ароматические аминокислоты. К раствору белка прибавляют концентрированную азотную кислоту. Белок свертывается. При нагревании белок желтеет. При добавлении избытка аммиака (в щелочной среде) окраска переходит в оранжевую. Появление окрашивания свидетельствует о наличии ароматических аминокислот в составе белка. 
5) Окислительные свойства «царской водки»:
Смесь концентрированных азотной и соляной кислот в объемном соотношении 1: 3 обладает еще большей окислительной активностью, они могут растворять даже золото и платину:
HNO3 + 4HCl + Au = H[AuCl4] + NO + 2H2O;
4HNO3 + 18HCl + Pt = 3H2[PtCl6] + 4NO + 8H2O
Химические реакции с азотной кислотой
4HNO3 = 4NO2 + 2H2O + O2 (комн., на свету).
HNO3 + H2O = NO3– + H3O+.
HNO3 (разб.) + NaOH = NaNO3 + H2O,
HNO3 (разб.) + NH3 · H2O = NH4NO3 + H2O.
2HNO3 (2-3%-я) + 8H0(Zn, разб. H2SO4) = NH4NO3 + 3H2O,
2HNO3 (5%-я) + 8H0(Mg, разб. H2SO4) = N2O ↑ + 5H2O,
HNO3 (30%-я) + 3H0(Zn, разб. H2SO4) = NO2↑ H2O,
HNO3 (60%-я) + 2H0(Zn, разб. H2SO4) = HNO2 + H2O. (кат Pd)
2HNO3 (конц.) +Ag = AgNO3 + NO2 ↑ + H2O.
8HNO3 (разб.) + 3Cu = 3Cu(NO3)2 + 2NO↑ + 4H2O
10HNO3 (разб.) + 4Mg = 4Mg(NO3)2 +N2O↑ + 5H2O (примесь H2)
12HNO3 (разб.) + 5Sn —t—5Sn(NO3)2 + N2 ↑ + 6H2O (примесь NO)
30HNO3 (оч. разб.) + 8Al = 8Al(NO3)3 + 3 NH4NO3 + 9H2O (примесь H2)
12HNO3 (оч. разб.) + 5Fe = 5Fe(NO3)2 + N2 ↑ + 6H2O (0-10 oC),
4HNO3 (разб.) + Fe = Fe(NO3)3 + NO↑ + 2H2O.
4HNO3 (конц., гор.) + Hg = Hg(NO3)2 + 2NO2 ↑ + 2H2O,
8HNO3(разб., хол) + 6Hg = 3Hg2(NO3)2 + 2NO ↑ + 4H2O.
6HNO3 (конц.) + S = H2SO4 + 6NO2 ↑ + 2H2O (кип.),
2HNO3 (конц.) + 6HCl(конц.) = 2NO↑ + 3Cl2↑ + 4H2O (100-150 oC).
HNO3 (конц.) + 4HCl(конц.) + Au = H[AuCl4] + NO↑ + 2H2O.
4HNO3 (конц.) + 18HCl(конц.) + 3Pt = 3H2[PtCl6] + 4NO↑ + 8H2O
4HNO3 (конц.) + 18HF(конц.) + 3Si = 3H2[SiF6] + 4NO↑ + 8H2O.
4HNO3 (дымящ.) + P4O10 = 2N2O5 + 4HPO3 (в атмосфере O2+O3)