Тип урока: урок открытия новых знаний
Цели урока:
· Формирование понятий о химическом равновесии и способах его смещения;
· Формирование представлений о константе химического равновесия, умений записывать выражения константы равновесия для гомогенных и гетерогенных реакций;
· Выявление единства и взаимосвязи химических превращений в реакциях между неорганическими и органическими веществами, их познаваемость, возможность управления химическими реакциями.
Изучение нового материала
Учащимся демонстрируется бутылка с газированной минеральной водой и предлагается ответить на вопрос, какие процессы в данный момент протекают в бутылке.
Учитель: почему мы не наблюдаем видимых признаков реакций?
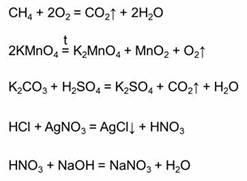
Все химические реакции делятся на обратимые и необратимые. Необратимые реакции – это реакции, которые идут только в одном направлении. Необратимыми являются реакции горения (например, реакция горения метана), большинство реакций термического разложения сложных веществ (например, реакция разложения перманганата калия), необратимыми являются большинство реакций, в результате которых образуется газ (например, реакция карбоната калия с серной кислотой), образуется осадок (например, в реакции соляной кислоты с нитратом серебра), или если образуется малодиссоциирующее вещество (например, в реакции азотной кислоты и гидроксида натрия).
Обратимыми называются реакции, которые одновременно протекают в прямом и обратном направлении. В уравнениях обратимых реакций используют знак обратимости.

Реакция образования веществ С и D является прямой, а реакция образования А и В является обратной.

Обратимыми являются также реакции этерификации – это реакции взаимодействия карбоновых кислот со спиртами.
|
|
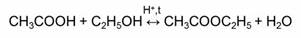
Одни и те же реакции при различных условиях могут быть обратимыми и необратимыми. Например, реакция разложения карбоната кальция. В открытой системе эта реакция является необратимой, так как углекислый газ выходит из зоны реакции, а в замкнутой системе эта реакция является обратимой, так как углекислый газ не уходит из зоны реакции.

Обратимой является реакции синтеза йодоводорода из водорода и йода.
После некоторого времени после начала реакции в газовой смеси можно обнаружить не только йодоводород, но и исходные вещества – водород и йод. Если взять в качестве исходного вещества йодоводород, то через некоторое время также наряду с образовавшимися водородом и йодом в смеси будет содержаться йодоровород.
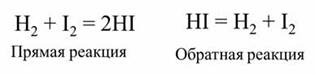
Если в качестве исходных веществ взять водород и йод, то скорость прямой реакции будет равна произведению концентраций водорода и йода.

Скорость обратной реакции будет равна концентрации йодоводорода взятой в квадрате.
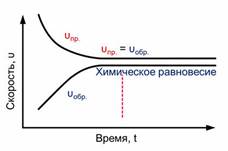
Постепенно скорость прямой реакции уменьшается, потому что водород и йод начинают реагировать и их концентрации уменьшаются.
Скорость же обратной реакции увеличивается, потому что концентрация образующегося йодоводорода увеличивается. Как только скорость прямой реакции окажется равной скорости обратной реакции, наступит химическое равновесие. Это равновесие считается динамическим, так как идут и прямая, и обратная реакции, скорости их также равны, а значит и концентрации веществ не изменяются. То есть их концентрации являются равновесными.
|
|
Если рассмотреть реакцию образования веществ C и D из А и B, то скорость прямой реакции будет равна произведению равновесных концентраций А и B с учётом их стехиометрических коэффициентов.
Скорость обратной реакции будет равна произведению равновесных концентраций C и D с учётом их стереохимических коэффициентов.
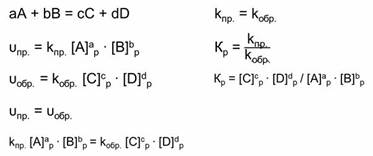
Так как в состоянии химического равновесия скорость прямой реакции равна скорости обратной реакции, то предыдущие выражения можно приравнять.
Константа скорости прямой и обратной реакции является величиной постоянной. А отношение констант скоростей прямой и обратной реакции является величиной постоянной, которая называется константой равновесия.
Константа равновесия зависит от температуры и давления, но не зависит от концентрации реагирующих веществ. Катализатор также не влияет на константу равновесия, но уменьшает время достижения равновесия.
Химическое равновесие является подвижным. То есть изменения внешних условий ведёт к смещению или сдвигу химического равновесия. Состояние же химического равновесия при неизменных внешних условиях может сохраняться бесконечно долго. Для многих химических производств состояние равновесия является нежелательным, так как не приводит к нужному выходу продукции. И поэтому для таких химических реакций нужно создавать условия, когда равновесие будет смещаться в нужную сторону.
Общий принцип химического равновесия был сформулирован французским учёным Анри Ле Шатэлье в 1884 году.
В современной трактовке он звучит следующим образом: Е сли на равновесную систему оказать внешнее воздействие, то равновесие сместится таким образом, чтобы уменьшить влияние этого воздействия.
|
|
Поскольку равновесие определяется скоростями прямой и обратной реакций, то и смещение равновесия также зависит от тех факторов, от которых зависит скорость реакции. А именно, от концентрации реагирующих веществ, температуры и давления.
Рассмотрим влияние каждого фактора на примере реакции образования аммиака
N2 (г) + H2 (г) 2NH3(г) + Q
Рассмотрим влияние концентрации на смещение химического равновесия. Как правило, при увеличении концентрации исходных веществ, равновесие смещается в сторону прямой реакции, при увеличении концентрации продуктов реакции равновесие смещается в сторону обратной реакции.
1) С – концентрации исходных веществ
С исх.
2) P – давление. Как же влияет давление на смещение химического равновесия? Давление газов в системе при постоянной температуре определяется числом молекул газообразных веществ, или химическим количеством этих веществ. Поэтому для оценки влияния изменения давления необходимо подсчитать число молей газообразных веществ в левой и правой частях уравнения. При увеличении давления увеличивается концентрация газообразных веществ.
Например, в реакции синтеза аммиака из азота и водорода образуется 2 моль аммиака из исходных четырёх моль азота и водорода. Следовательно, было 4 объёма исходных веществ и образовалось 2 объёма аммиака. При увеличении давления объём уменьшается, поэтому идёт реакция образования аммиака. При уменьшении давления, объём увеличивается, что способствует реакции разложения аммиака на исходные вещества.
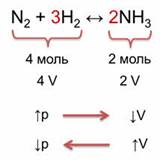
Таким образом, при увеличении давления равновесие смещается в сторону той реакции, при которой объём образующихся газообразных веществ уменьшается, и, наоборот, при уменьшении давления равновесие смещается в сторону той реакции, которая приводит к увеличению объёма. То есть, при увеличении давления равновесие смещается в сторону образования аммиака (вправо), а при уменьшении давления равновесие смещается в сторону исходных веществ (влево).
3) t – температура
Влияние температуры – увеличение температуры смещает равновесие в сторону эндотермической реакции.
а) N2 (Г) + 3H2 (Г) ↔ 2NH3 (Г) + 92,4 кДж (экзотермическая – выделение тепла)
При повышении температуры равновесие сместится в сторону реакции разложения аммиака (←)
б) N2 (Г) + O2 (Г) ↔ 2NO (Г) – 180,8 кДж (эндотермическая - поглощение тепла)
При повышении температуры равновесие сместится в сторону реакции образования NO (→).
Катализаторы не влияют на смещение химического равновесия, так как они одинаково ускоряют как прямую, так и обратную реакцию. То есть катализаторы только ускоряют наступление химического равновесия. Например, дрова быстрее загораются, если их порубить (то есть увеличить площадь поверхности соприкосновения реагирующих веществ; на сильном огне быстрее закипит вода (потому то увеличивается температура), смазанные маслом детали автомобилей не ржавеют, так как не будет доступа кислорода.
Домашнее задание
Решите задачи:
№1. Исходные концентрации СO и O2 в обратимой реакции
2CO (г) + O2 (г)↔ 2 CO2 (г)
Равны соответственно 6 и 4 моль/л. Вычислите константу равновесия, если концентрация CO2 в момент равновесия равна 2 моль/л.
№2. Реакция протекает по уравнению
2SO2 (г) + O2 (г) = 2SO3 (г) + Q
Укажите, куда сместится равновесие, если
а) увеличить давление
б) повысить температуру
в) увеличить концентрацию кислорода
г) ввести катализатор?