Гипотеза
При определенных факторах яичный белок поддается процессу денатурации
Задачи
1. Изучить литературу
2. Отобрать варианты химических и физических денатурирующих факторов
3. Провести опыт с применением факторов, приводящих к денатурации
4. Проверить гипотезу за счет отсутствия нативных свойств белка (растворимости в воде)
5. Сделать вывод
6. Представить полученную информацию
Предмет и объект исследования
Предмет — денатурация белка.
Объект — яичный белок.
Методы сбора информации
Главный метод сбора информации – наблюдение. Благодаря опыту, я смогу проверить поставленную гипотезу.
Теоретическая часть
Доказано, что белки составляют, в среднем, до 50% от сухой массы практически всех живых существ. Основным структурным элементом белка является аминокислота. В составе каждой из аминокислот имеется карбоксильная (кислотная) и аминогруппа. При комбинации этих групп появляется пептидная связь, поэтому второе название белков – полипептиды.
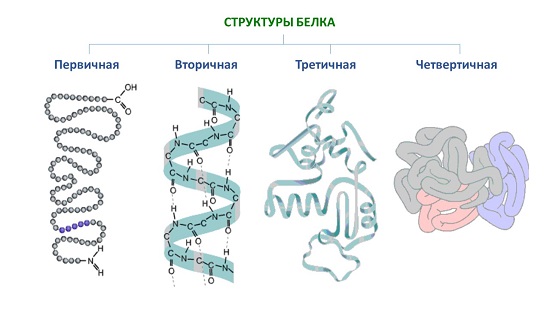
Первичная структура - цепь, состоящая из аминокислот, соединенных пептидной связью (мощной, ковалентной). При чередовании 20 аминокислот в разном порядке образуется множество разнообразных белков. В случае замены в определенной белковой цепочке хотя бы одной аминокислоты полностью меняется структура и, соответственно, функции белка. Поэтому первичная структура по праву является основной в белке.
Вторичная. Это спираль, форма которой поддерживается водородными связями (относительно слабыми).
Третичная структура – это шар, или так называемая глобула. Она образована, благодаря четырем видам связей. Из них наиболее мощная дисульфидная (так называемый серный мостик). Более слабыми являются такие связи, как гидрофобные, ионные, водородные. Функции белка определяются формой глобулы, по которой белки сильно отличаются друг от друга. Вследствие денатурации происходит изменение формы белка, что влечет нарушение его функции.
|
|
Четвертичная структура характерна не для всех белков. Представлена несколькими глобулами, объединенными друг с другом теми же связями, что и в третичной структуре. Ярким примером является гемоглобин.
Функции белка:
1. Структурная (строительная) заключается в том, что любая живая клетка состоит, в большей степени, из белков и воды.
2. Ферментативная выражается в том, что существуют белки-ферменты, выполняющие роль ускорителей химических реакций. Это происходит, так как активная часть фермента подходит к определенному веществу как ключик к замку.
3. Защитная функция ярко прослеживается на примере организма животного, где белки-антитела иммунной системы уничтожают болезнетворные микроорганизмы.
4. Транспортная. Белки являются переносчиками витаминов, гормонов, жирных кислот и др. веществ.
5. Обеспечивают нормальное функционирование иммунной системы.
6. Обеспечивают состояние "аппарата наследственности".
7. Являются катализаторами всех биохимических метаболических реакций организма.
Белки подразделяются на 2 категории:
Животный, который поступает из продуктов животного происхождения. К этой категории можно отнести мясо, птицу, рыбу, молоко, масло, творог и яйца.
Растительный, который организм получает из растений. Здесь стоит выделить рожь, овсянку, грецкие орехи, чечевицу, фасоль, сою и морские водоросли.
|
|
Под денатурацией понимают изменение пространственной структуры белков и, как следствие, уменьшение или полное подавление функциональной активности, растворимости и других биологических и физико-химических свойств. С этим процессом мы встречаемся в повседневной жизни, самый примитивный пример — приготовление блюд из яиц (вареные или жареные яйца).
Следует различать денатурацию и деградацию белков. При деградации происходит фрагментация первичной структуры и образование фрагментов белковой макромолекулы. Денатурация не сопровождается фрагментацией, однако может происходить разрыв дисульфидных мостиков, а также слабых водородных, гидрофобных и электростатических связей. В результате изменениям подвергается четвертичная (при ее наличии), третичная и в меньшей степени вторичная структуры.
Денатурирующие агенты делятся на химические и физические. К последним относится прежде всего температурное воздействие, в частности замораживание или нагревание, а также давление, ультразвуковое воздействие, облучение и др. Химические агенты — это органические растворители (ацетон, хлороформ, спирт), концентрированные кислоты, щелочи, ионы тяжелых металлов.
В лабораторной практике в качестве денатурирующих агентов чаще всего используют мочевину или гуанидинхлорид, легко разрывающие водородные и гидрофобные связи, при помощи которых формируется третичная структура белка. Максимальное денатурирующее действие оба реагента проявляют при высоких концентрациях (8—10 моль/л).
|
|
Тепловая денатурация белков в растворах при 50—60°С также связана с разрывом связей, при помощи которых образуется третичная структура.
Денатурация может быть:
- Обратимой, если возможно восстановление свойственной белку структуры. Такой денатурации подвергаются, например, рецепторные белки мембраны.
- Необратимой, если восстановление пространственной конфигурации белка невозможно. Обычно это происходит при разрыве большого количества связей, например, при варке яиц.
Если белок подвергся обратимой денатурации, то при восстановлении нормальных условий среды он способен полностью восстановить свою структуру и, соответственно, свои свойства и функции. Процесс восстановления структуры белка после денатурации называется ренатурацией. Для ряда белков восстановление связей может быть 100%-м, причем это касается не только водородных или гидрофобных связей, но и дисульфидных мостиков.
Известен случай, при котором американские и австралийские химики выяснили, как обратить процесс денатурации белка, или, проще говоря, вернуть сваренное вкрутую яйцо в жидкое, вновь сырое, состояние.
На первый взгляд, открытие действительно может показаться бесполезным. Но оно может существенно снизить затраты на лечение рака, производство продуктов питания и пригодится в других областях индустрии биотехнологий.
Для возвращения "крутого" белка в жидкое состояние учёные использовали мочевину, которая способна "расцеплять" белки и разжижать твёрдый материал. Однако это лишь половина процесса: на молекулярном уровне некоторые группы протеинов всё ещё оставались сцепленными.
Калифорнийские учёные использовали центрифугу, разработанную специалистами университета Флиндерса в Южной Австралии и вращающуюся со скоростью 5 километров в минуту. С её помощью белки были подвергнуты определённой нагрузке, которая "распутала" их структуру и вернула в жидкую форму.
Денатурация изменяет как стабильность, так и функции белков, поэтому весьма важно определять ее характер в научных экспериментах, а также при применении белков в промышленности и медицине.
Как правило, при денатурации изменяется форма белковой молекулы, поэтому для контроля ее нативности применяют такие методы, как коэффициент вращательной диффузии, рассеяние света, электронная микроскопия.
Кроме того, при переходе молекулы белка в денатурированную форму меняется ее растворимость, спектры поглощения, иммунохимические свойства.
Практическая часть
Изучив теорию, я выбрала один химический и один физический факторы.
Подготовив материалы, я приступила к опытам
Оба опыта я проводила со съемкой фотографий.
Опыт №1
1. отделила яичный белок от желтка
2. в чашку налила воду температурой ͌ 99°С
- поместила белок в воду (приложение 1,2)
- записала результат
Опыт №2
- я вновь отделила белок и поместила его в чашку
- залила туда 50 мл спирта (приложение 3,4)
- описала результат
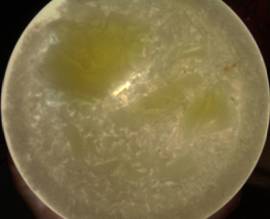
Чтобы можно было хорошо увидеть результат опыта, я подсветила чашку сверху (приложение 5). Следующим этапом нужно было проверить свойство белка — растворимость. Белок из обоих опытов я попробовала растворить в воде (приложение 6,7).
Вывод
Поместив продукты опытов в воду, я хорошо перемешала данную белую массу. Как ожидалось, белок не растворился. Из этого можно сделать вывод, что яичный белок действительно денатурировал.
Таким образом, задачи исследовательской работы решены, поставленная цель достигнута, гипотеза подтверждена.
В чем заключается опасность денатурации белка для человека, как для высшей белковой структуры?
Как уже было сказано, наша кровь содержит множество белков. Температура тела человека от 35,5 до 37,2°C считается нормальной. Как стало ясно из опыта, при нагревании некоторые структуры белка разрушаются, теряются многие свойства, и белок «умирает». Этот же процесс происходит, когда температура тела человека становится более 40°C – кровь «сворачивается» (точнее белок в ней), что приводит к летальному исходу. Именно поэтому важно сбивать высокую температуру у человека.
Источники
1. «Белки, жиры, углеводы. Справка»: https://ria.ru/20100823/268098907.html
2. «Денатурация и ренатурация белков»: https://studfile.net/preview/2486977/page:149/
3. «Роль белков, жиров и углеводов в организме человека»: students.kpfu.ru/node/14066
4. «Строение и функции белков»: https://beaplanet.ru/stroenie_rasteniy/stroenie_i_funkcii_belkov.html
5. «Химики превратили вареное яйцо в сырое»: https://www.vesti.ru/nauka/article/1041930
6. «Shear‐Stress‐Mediated Refolding of Proteins from Aggregates and Inclusion Bodies»: https://chemistry-europe.onlinelibrary.wiley.com/doi/abs/10.1002/cbic.201402427
Приложение
Приложение 1 Приложение 2


Приложение 3 Приложение 4

Приложение 5
Приложение 6 Приложение 7

