При протекании тока через ячейку потенциал его отклоняется от равновесного (ЕР):
Е - ЕР = h (5.3)
Величина этого отклонения называется поляризацией или перенапряжением, а электрод, потенциал которого отличается от равновесного, называется поляризованным. Чтобы через поляризованную электрохимическую ячейку протекал требуемый ток, на нее нужно наложить потенциал выше теоретического.
Причины возникновения перенапряжения различны. В зависимости от характера лимитирующей (наиболее медленной) стадии электродного процесса различают следующие виды поляризации:
Концентрационная поляризация - наблюдается в том случае, если скорость переноса реагирующего вещества из глубины раствора в приэлектродный слой недостаточна, чтобы поддержать теоретически предсказанную силу тока. Перенос вещества осуществляется в растворе под действием диффузии, электростатического притяжения или отталкивания, механических или конвекционных сил.
Кинетическая поляризация - возникает при малой скорости электрохимической реакции, сила тока контролируется скоростью переноса электрона. В этом случае для преодоления энергетического барьера полуреакции требуется дополнительная энергия (перенапряжение). Перенапряжение увеличивается обычно с увеличением плотности тока; уменьшается с повышением температуры; зависит от материала электрода (чаще всего оно выше на электродах, изготовленных из мягких металлов, например, Pb, Hg, Zn). Перенапряжение более заметно для электродных процессов, протекающих с образованием газообразных продуктов. Большой интерес представляет тот факт, что выделение водорода или кислорода на электродах протекает с высоким перенапряжением, что дает возможность проводить электрохимическое осаждение металлов.
Величину перенапряжения в каждом конкретном случае предсказать точно нельзя, поскольку оно определяется рядом неконтролируемых факторов.
Фазовая поляризация - связана с замедленной стадией образования новой фазы (построение кристаллической решетки при осаждении металла и др.)
Существуют и другие виды поляризации, которые в меньшей степени используются в электрохимических методах анализа.
Потенциометрия
Потенциометрический метод основан на измерении разности равновесных потенциалов практически в отсутствие тока между индикаторным электродом и электродом сравнения, погруженными в анализируемый раствор, в гальванической цепи типа:
 |  |  |
электрод сравнения исследуемый раствор индикаторный
электрод
Например,



 Hg Hg2Cl2, KCl Fe3+, Fe2+ Pt
Hg Hg2Cl2, KCl Fe3+, Fe2+ Pt
Измеряемое напряжение, таким образом, равно:
E = Eинд. - Еср.
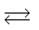
|
Возникновение электродного потенциала связано с электродным процессом на границе: индикаторный электрод - раствор, содержащий окислительно - восстановительную пару:
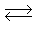
|
Mn++ n e Мо
Oк + n e Вос
При установлении динамического равновесия электрод приобретает равновесный потенциал. Реакции, протекающие на границе раздела электрод - раствор, называются потенциалопределяющими, а ионы [Ок.],[Вос.] - потенциалопределяющими ионами. Потенциал индикаторного электрода зависит от активности потенциалопределяющих ионов по уравнению Нернста:
E = Eo + 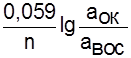
Eo - стандартный электродный потенциал, В.