Потенциометрические измерения часто используются для исследования реакций в растворе, определения констант равновесия и различных характеристик вещества. По данным потенциометрических измерений вычисляют константы диссоциации кислот и оснований, константы устойчивости координационных соединений, произведение растворимости, рассчитывают тепловые эффекты и другие термодинамические характеристики процессов в растворе.
Например, константу диссоциации слабой кислоты можно определить по экспериментально измеренным значениям рН растворов известной концентрации или по кривой титрования данной кислоты щелочью, строя график в координатах рН - V щелочи (рис.3).

Потенциометрические измерения сравнительно легко могут быть автоматизированы. Имеется ряд автоматических приборов для потен-циометрического титрования - автотитраторы.
Прямая потенциометрия широко применяется в агрохимических и почвенных лабораториях для определения рН мутных и окрашенных растворов, химическом контроле пищевых продуктов, в биологических и медицинских исследованиях.
К недостаткам потенциометрического титрования можно отнести не всегда быстрое установление потенциала индикаторного электрода после добавления титранта, а также необходимость делать большое число отсчетов при титровании.
Схема
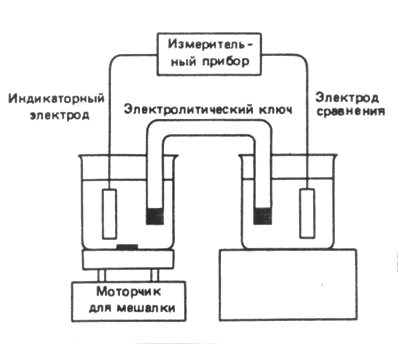
Для определения рН растворов в качестве индикаторных электродов используют водородный либо стеклянный электрод. В стеклянном электроде, как и в хлоридсеребряном, имеется серебряная проволока, покрытая хлоридом серебра и погруженная в раствор 0,1 М соляной кислоты. Электрод отделен от измерительной системы стеклянной мембраной, проницаемой только для ионов водорода. Если рН раствора выше рН электрода, то ионы водорода переходят в раствор, заряжая электролит внутри мембраны отрицательно, а вне мембраны – положительно. Избыток отрицательного заряда электролита вызывает сдвиг равновесия полуреакции, при этом анионы хлора связываются с металлическим серебром в хлорид серебра, сообщая электроду избыточный отрицательный заряд. Таким образом, потенциал стеклянного электрода пропорционален рН раствора.
Автотитраторы

Принцип работы
Титратор - помощник лаборанта. При титровании вручную можно выделить несколько операций, которые проделывает аналитик: приготовление образца, добавление титранта, контроль добавление (уменьшение или увеличение объема в зависимости от приближения к конечной точки титрования), визуальное определение окончания титрования, расчет результатов. Все эти же стадии титратор делает самостоятельно. Блок прибора содержит измерительные интерфейсы, в которые подключаются электроды или датчики (для фотометрического определения). Именно эти элементы обеспечивают получение сигнала анализа. Прибор автоматически добавляет титрант в нескольких режимах:
1. Монотонное титрование - добавляемый объем постоянен. Данный режим используется в случаях, когда химическая реакция протекает медленно.
2. Динамическое титрование - добавляемый объем переменный. В начале титрования добавляются большие количества титранта. При приближении к конечной точки титрования титратор автоматическиснижает объем добавки и в самой конечной точке объем принимает минимальные значения. Данный вариант подходит для 90% анализов.
3. Титрование до конечной точки - остановка титрования жестко закреплена для определенного значения pH или потенциала. Используется в случаях, когда данные значения известны, например, описаны в стандарте.
Расчет результатов и отображение кривых титрования обеспечивают системы управления: сенсорная панель, либо программное обеспечение.
|
РН метры
Двухканальный pH-метр для рутинного применения в лаборатории и в полевых условиях. 


