Пятичленные гетероциклы
Пиридин
Азотсодержащее гетероциклическое соединение. Его особенности:
1) это шестичленное гетероциклическое соединение с одним гетероатомом азота в цикле:

2) это бесцветная жидкость с неприятным запахом, хорошо растворимая в воде;
3) пиридин и его гомологи содержатся в каменноугольной смоле, которая и служит источником их получения;
4) на основании структурной формулы можно высказать двоякое суждение о свойствах пиридина;
5) наличие двойных связей в молекуле указывает на его высокую реакционноспособность, а сходство по строению с бензолом позволяет предположить, что вещество обладает большой химической способностью;
6) пиридин также имеет и много общего с бензолом по строению и свойствам.
В молекуле бензола каждый атом углерода, находясь в состоянии sр2-гибридизации, три электрона затрачивает на образование δ-связей и один электрон – на образование общего для молекулы π-облака (при боковом перекрывании облаков шести р -электронов). В молекуле пиридина одну группу СН заменяет атом азота, и он «поставляет» два электрона на установление δ-связей с двумя соседними углеродными атомами и один электрон – в систему π-облака, при этом, как и в молекуле бензола, образуется устойчивый секстет электронов. У атома азота остается после этого еще пара свободных электронов;
7) пиридин, как и бензол, устойчив по отношению к окислителям: он не обесцвечивает раствор перманганата калия даже при нагревании;
8) пиридин нитруется, реакция идет в более жестких условиях, чем у бензола, образуется нитропиридин:

1. Основные свойства. Пиридин — более слабое основание, чем алифатические амины. Его водный раствор окрашивает лакмус в синий цвет:

При взаимодействии пиридина с сильными кислотами образуются соли пиридиния:

2. Ароматические свойства. Подобно бензолу, пиридин вступает в реакции электрофильного замещения, однако, его активность в этих реакциях ниже, чем бензола, из-за большой электроотрицательности атома азота. Пиридин нитруется при 300 ° С с низким выходом:

Атом азота в реакциях электрофильного замещения ведет себя как заместитель 2-го рода, поэтому электрофильное замещение происходит в мета- положение.
В отличие от бензола пиридин способен вступать в реакции нуклеофильного замещения, поскольку атом азота оттягивает на себя электронную плотность из ароматической системы и орто-пара- положения по отношению к атому азота обеднены электронами. Так, пиридин может реагировать с амидом натрия, образуя смесь орто- и пара- аминопиридинов (реакция Чичибабина):

При гидрировании пиридина ароматическая система разрушается и образуется пиперидин, который представляет собой циклический вторичный амин и является гораздо более сильным основанием, чем пиридин:

Гетероциклическое соединение пиридин – это азотистое основание ароматического характера.
Применение пиридина:
1) ароматические и основные свойства пиридина используются при синтезе разного рода лекарственных препаратов, красителей, гербицидов;
2) также пиридин используется как растворитель для денатурирования этанола;
3) Ядро пиридина содержится в молекулах витамина РР, предупреждающего развитие пеллагры – заболевания кожи.
Пиррол
Пятичленный гетероцикл с одним атомом азота.

При рассмотрении электронного строения молекулы пиррола видно, что электронная пара пиррольного азота участвует в образовании шестиэлектронной структуры, поэтому этот азот практически не обладает основными свойствами.
Пиррол — жидкость без цвета, tкип=130°С. Пиррол на воздухе окисляется и при этом темнеет.
Значение пиррола и его соединении
Пиррол — важный продукт для получения пирролидина путем каталитического гидрирования. Огромное значение в жизни растений и животных имеет ядро пиррола, которое является составной частью гемоглобина и хлорофилла.
Соединения с пятичленным циклом. Пиррол C4H4NH - пятичленныи гетероцикл с одним атомом азота.

Ароматическая система содержит шесть p -электронов (по одному от четырех атомов углерода и пара электронов атома азота). В отличие от пиридина электронная пара атома азота в пирроле входит в состав ароматической системы, поэтому пиррол практически лишен основных свойств.
Пиррол — бесцветная жидкость с запахом, напоминающим запах хлороформа. Пиррол слабо растворим в воде (< 6%), но растворим в органических растворителях. На воздухе быстро окисляется и темнеет.
Пиррол получают конденсацией ацетилена с аммиаком:

или аммонолизом пятичленных циклов с другими гетероатомами (реакция Юрьева):

Сильные минеральные кислоты могут вытягивать электронную пару атома азота из ароматической системы, при этом ароматичность нарушается и пиррол превращается в неустойчивое соединение, которое сразу полимеризуется. Неустойчивость пиррола в кислой среде называется ацидофобностью.
Пиррол проявляет свойства очень слабой кислоты. Онреагирует с калием, образуя пиррол-калий:

Пиррол, как ароматическое соединение, склонен к реакциям электрофильного замещения, которые протекают преимущественно у a -атома углерода (соседнего с атомом азота).
При гидрировании пиррола образуется пирролидин — циклический вторичный амин, проявляющий основные свойства:

| азвание | Пиррол | Пиридин |
| Формула | C4H5N, C4H4NH | C5H5N |
| Значение | Пиррольные ядра входят в состав порфина – соединения, лежащего в основе гемоглабина и хролофилла. | Производные пиридина широко распространены в природе и играют важную роль в функционировании живых организмов. Ядро этого гетероцикла создается в витамине В1, некоторых антибиотиках, пиримидинованых основаниях. |
| Строение | 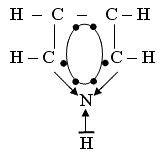 1) SP2 – гибридизация у атомов углерода.
2) образуется ароматическое кольцо.
3) атом водорода азота подвижен и способен замещаться.
1) SP2 – гибридизация у атомов углерода.
2) образуется ароматическое кольцо.
3) атом водорода азота подвижен и способен замещаться.
|  1) SP2 – гибридизация у атомов углерода.
2) образуется ароматическое кольцо.
3) На атоме азота – неподеленная электронная пара.
1) SP2 – гибридизация у атомов углерода.
2) образуется ароматическое кольцо.
3) На атоме азота – неподеленная электронная пара.
|
| Вывод: Химические свойства | пиррол – кислота ароматического характера.
I. Как кислота
2C4H4N H +2K —> 2C4H4NK+H2  пиррол карий
II. Как ароматическое соединение:
а) замещение
C4H4NH+4I2 —> C4I4NH++4 HI тетроиод пиррол
б) присоединение
C4H4NH+H2 —> пирролидин пиррол карий
II. Как ароматическое соединение:
а) замещение
C4H4NH+4I2 —> C4I4NH++4 HI тетроиод пиррол
б) присоединение
C4H4NH+H2 —> пирролидин
| пиридин – азотистое основание ароматического характера. I. Как основание ·C5H5N+H2O —> [C5H5NH]OH гидроксид пиридина ·C5H5N+HCE —> [C5H5NH]CE хлорид пиридина II. Как ароматическое соединение: а) замещение C5H5N+H2SO4 —> [C5H4N]HSO3+H2O сульфопиридин C5H5N+HNO3 —> [C5H4N]NO2+H2O нитропиридин б) присоединение C5H5N+3H2 —> C5H11N пипиридин |
Пиррол, как p -избыточный гетероцикл, легко вступает в реакции электрофильного замещения. Активность пиррола по отношению к электрофилам выше, чем у бензола, и близка к активности анилина и фенола. Электрофильное замещение направляется преимущественно в положение 2. Из-за ацидофобности пиррола SE-реакции проводятся в отсутствии кислот.
