| № п/п | Концентрация кислоты,
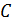 , моль/л , моль/л
| 
| Измеренное значение 
| Значение 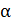 , рассчитанное по экспериментальной , рассчитанное по экспериментальной 
| ||||
| Сред-нее | 
| |||||||
Для определения константы диссоциации выполнить все расчеты по разделу «Определение параметров по результатам косвенных измерений». В данной работе  . После определения
. После определения  и коэффициента Стьюдента рассчитывают доверительный интервал и, соответственно, верхнюю и нижнюю границы
и коэффициента Стьюдента рассчитывают доверительный интервал и, соответственно, верхнюю и нижнюю границы  , по которым, после потенцирования, находят верхнее и нижнее значения константы диссоциации. Расчеты и построение графиков можно выполнить в пакете Excel, представив в отчете все промежуточные результаты.
, по которым, после потенцирования, находят верхнее и нижнее значения константы диссоциации. Расчеты и построение графиков можно выполнить в пакете Excel, представив в отчете все промежуточные результаты.
Лабораторная работа №2.
Определение  раствора кислоты
раствора кислоты
Константа диссоциации для кислот слабых и средней силы может быть описана выражением (2.3)
 ,
,
где 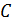 – исходная молярная концентрация кислоты.
– исходная молярная концентрация кислоты.
Для кислот средней силы степень диссоциации α не настолько мала, чтобы можно было пренебречь ею по сравнению с единицей в знаменателе уравнения (2.3). В расчетах будем пользоваться размерностью концентрации моль/л, так как стандартное значение концентрации в этой шкале равно единице.
Умножим и разделим правую часть уравнения (2.3) на концентрацию
 (2.20)
(2.20)
и прологарифмируем полученное соотношение:
 . (2.21)
. (2.21)
Водородный показатель зависит от концентрации ионов водорода по уравнению (2.4), а равновесная концентрация ионов водорода равна
 . С учетом этого
. С учетом этого
 . (2.22)
. (2.22)
Произведение  можно определить по экспериментально измеренному значению
можно определить по экспериментально измеренному значению 
 . (2.23)
. (2.23)
Из уравнения (2.21)) можно получить выражение для  раствора кислоты средней силы:
раствора кислоты средней силы:
 . (2.24)
. (2.24)
Полученное соотношение в координатах  представляет собой прямую линию. На оси ординат при этом отсекается отрезок, численно равный
представляет собой прямую линию. На оси ординат при этом отсекается отрезок, численно равный  , по которому можно оценить значение константы диссоциации кислоты. Линейность экспериментальной зависимости в указанных координатах свидетельствует о справедливости уравнения диссоциации Аррениуса.
, по которому можно оценить значение константы диссоциации кислоты. Линейность экспериментальной зависимости в указанных координатах свидетельствует о справедливости уравнения диссоциации Аррениуса.
Цель работы – измерить значение  раствора щавелевой кислоты и, установив зависимость
раствора щавелевой кислоты и, установив зависимость  от концентрации, рассчитать значение константы диссоциации кислоты.
от концентрации, рассчитать значение константы диссоциации кислоты.
Экспериментальная часть
Объектом исследования является щавелевая кислота  , константа диссоциации которой по первой ступени
, константа диссоциации которой по первой ступени 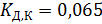 согласно справочнику [5]. Значительная величина константы диссоциации (на три порядка больше по сравнению с уксусной кислотой) не позволяет пользоваться соотношением (2.6) для расчета
согласно справочнику [5]. Значительная величина константы диссоциации (на три порядка больше по сравнению с уксусной кислотой) не позволяет пользоваться соотношением (2.6) для расчета  . Исходные растворы содержат соответственно 1 моль/л и 0,1 моль/л щавелевой кислоты. Константа диссоциации по второй ступени на три порядка меньше, чем по первой, так что кислоту можно в первом приближении считать одноосновной.
. Исходные растворы содержат соответственно 1 моль/л и 0,1 моль/л щавелевой кислоты. Константа диссоциации по второй ступени на три порядка меньше, чем по первой, так что кислоту можно в первом приближении считать одноосновной.
Из исходных растворов путем разбавления водой необходимо приготовить 6 растворов с разной заданной концентрацией и заданного объема. Рассчитав необходимые для приготовления нужного раствора объемы исходной щавелевой кислоты и воды, отбирают эти жидкости в нужном количестве с помощью мерной посуды – бюреток.
Величину  раствора измеряют, используя стеклянный электрод. Отодвинув поворотом в горизонтальной плоскости подставку со стаканчиком, заполненным водой, заменяют его на стакан с исследуемым раствором и опускают в него датчик стеклянного электрода. Измерения проводят не менее трех раз, каждый раз заменяя раствор на свежий.
раствора измеряют, используя стеклянный электрод. Отодвинув поворотом в горизонтальной плоскости подставку со стаканчиком, заполненным водой, заменяют его на стакан с исследуемым раствором и опускают в него датчик стеклянного электрода. Измерения проводят не менее трех раз, каждый раз заменяя раствор на свежий.
Для уменьшения экспериментальной ошибки следует проводить измерения в определенной последовательности: начиная с менее кислых растворов и кончая более кислыми.