Полученные результаты записывают в таблицу и строят 2 графика:  при постоянном расстоянии между электродами
при постоянном расстоянии между электродами  и
и 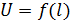 при постоянном токе
при постоянном токе 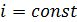 . При условии выполнения закона Ома (3.12) должны получиться прямолинейные зависимости, которые экстраполируются в начало координат, по тангенсу угла наклона прямых определяют значение удельной электропроводности раствора
. При условии выполнения закона Ома (3.12) должны получиться прямолинейные зависимости, которые экстраполируются в начало координат, по тангенсу угла наклона прямых определяют значение удельной электропроводности раствора 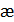 .
.
Поскольку от температуры зависит только удельное сопротивление электролита 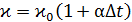 , то строят график в соответствии с уравнением
, то строят график в соответствии с уравнением  в координатах
в координатах  . По графику определяют
. По графику определяют  и
и 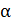 .
.
Другой способ, позволяющий обнаружить влияние удельной электропроводности на падение напряжения в электролите, − изменение концентрации раствора или изменение его природы.
При выполнении работы важно соблюдать условия: 1) катодная и анодная плотности тока должны быть минимальными, чтобы избежать заметных искажений результатов из-за электродной поляризации; 2) оба электрода должны быть из одного металла (медь марки М0), в противном случае возникнет ЭДС, обусловленная различной величиной электродных потенциалов.
Отчет включает в себя следующие разделы: теоретическую часть, цель работы, схему установки, описание методики измерения, таблицу результатов измерений, графики зависимостей  при постоянном расстоянии между электродами
при постоянном расстоянии между электродами  и
и 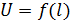 при постоянном токе
при постоянном токе 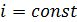 , расчет удельной электропроводности и сопоставление со справочными данными. При определении температурного коэффициента строят график в координатах
, расчет удельной электропроводности и сопоставление со справочными данными. При определении температурного коэффициента строят график в координатах  , по которому определяют свободный член и угловой коэффициент. Эти же величины можно получить расчетным путем. Из этих данных находят удельную электропроводность и температурный коэффициент удельной электропроводности.
, по которому определяют свободный член и угловой коэффициент. Эти же величины можно получить расчетным путем. Из этих данных находят удельную электропроводность и температурный коэффициент удельной электропроводности.
Лабораторная работа № 6. Зависимость удельной
и эквивалентной электропроводимостей
от концентрации электролита
Электропроводность растворов электролитов зависит от подвижности ионов  и их концентрации
и их концентрации 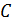 .
.
С ростом концентрации растворов электролитов увеличивается количество ионов, которые переносят электрический ток, что приводит к росту удельной электропроводности:
 . (3.13)
. (3.13)
Однако в концентрированных растворах электропроводность падает вследствие увеличения сил взаимодействия между ионами.
Ионы водорода и гидроксила обладают более высокой подвижностью в водных растворах, чем другие ионы:
 См·м2/(моль-экв);
См·м2/(моль-экв);
 См·м2/(моль-экв).
См·м2/(моль-экв).
Для сравнения  См·м2/(моль-экв),
См·м2/(моль-экв),
 См·м2/(моль-экв).
См·м2/(моль-экв).
Это явление объясняется эстафетным или гротгусовским механизмом перемещения ионов водорода и гидроксила. Происходит перескок протона от гидратированного иона гидроксония  к соседней молекуле воды. Аналогично объясняется высокая подвижность иона гидроксила.
к соседней молекуле воды. Аналогично объясняется высокая подвижность иона гидроксила.
Эквивалентная и молярная электропроводности характеризуют проводимость при одинаковом количестве вещества, но содержащемся в разных объемах и, поэтому отражают влияние сил межионного взаимодействия и сил взаимодействия ионов с молекулами растворителя.
Зависимость эквивалентной электропроводности от концентрации может быть описана эмпирическим уравнением:
 , (3.14)
, (3.14)
где 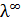 – электропроводность в бесконечно разбавленном растворе.
– электропроводность в бесконечно разбавленном растворе.
Цель работы состоит в исследовании зависимости удельной и эквивалентной электропроводности от состава и концентрации электролита.
Возможно несколько вариантов заданий на лабораторную работу.
Первый вариант. Зависимость удельной электропроводности водных растворов 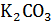 ,
, 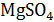 и
и 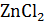 от концентрации.
от концентрации.
Второй вариант. Взаимное влияние двух электролитов на электропроводимость растворов. Измеряют электропроводность 0,5; 1,0; 1,25; 1,5 Н растворов 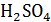 и
и  , а затем их смесей в соотношении 1:1 при комнатной температуре.
, а затем их смесей в соотношении 1:1 при комнатной температуре.
Третий вариант. Влияние концентрации электролита на эквивалентную электропроводность, определение предельной электропроводимости. Измеряют электропроводность 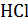 ,
,  ,
,  и
и  при 25 0С. Концентрации растворов 0,004; 0,002; 0,001 и 0,0005 моль-экв/л.
при 25 0С. Концентрации растворов 0,004; 0,002; 0,001 и 0,0005 моль-экв/л.
Экспериментальная часть
Для проведения работы необходимы следующие приборы:
1) мост переменного тока (кондуктометр);
2) термостат с мешалкой и терморегулятором;
3) посуда и бюретки для приготовления растворов;
4) сосуд (ячейка) для определения электропроводности.
Исследуемый электролит заливают в специальный сосуд для определения электропроводности. Конструкция сосудов может быть самой разнообразной; важно лишь, чтобы электроды в них были укреплены неподвижно.
Общее сопротивление раствора внутри сосуда должно быть не менее 10 и не более 5000 Ом, с учетом возможности измерительной установки.
Так как электропроводность растворов меняется в больших пределах, то и сосуды для разных электролитов используют различные. Для растворов с большой электропроводностью применяют сосуды с маленькими электродами, достаточно далеко отстоящими один от другого. При измерении электропроводности плохо проводящих растворов, наоборот, необходимо иметь сосуд возможно меньшей величины  .
.
Электропроводность измеряют с помощью моста переменного тока (рис. 3.2).
Сосуд для измерения электропроводимости в специальных случаях следует изготавливать из кварца или стекла «пирекс» и хранить залитыми бидистиллятом. Перед работой сосуды тщательно промывают водой и пропаривают, а затем 5-6 раз споласкивают раствором, электропроводимость которого будет определяться.

Рис. 3.2. Принципиальная схема моста переменного тока:
 – источник переменного тока;
– источник переменного тока;  – осциллограф;
– осциллограф; 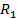 и
и 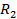 – активные сопротивления;
– активные сопротивления;
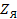 – сопротивление ячейки;
– сопротивление ячейки;  – переменное сопротивление моста
– переменное сопротивление моста
Все растворы готовят на бидистилляте. Перед началом измерения сосуд с раствором выдерживают в течение 15-20 мин в термостате, пока не установится постоянная температура. Для того чтобы определить удельную электропроводность изучаемых растворов, необходимо знать 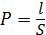 для данного сосуда (постоянную сосуда). Для этого измеряют сопротивление стандартного раствора, удельная электропроводимость которого заранее известна.
для данного сосуда (постоянную сосуда). Для этого измеряют сопротивление стандартного раствора, удельная электропроводимость которого заранее известна.
В качестве стандартных растворов обычно используют растворы хлорида калия. Для их приготовления мелкокристаллический или растертый хлорид калия обезвоживают прокаливанием при 300 0С в фарфоровой чашке при перемешивании стеклянной или фарфоровой палочкой, затем охлаждают и сохраняют в эксикаторе. Возможно использование растворов, приготовленных из фиксаналов.
После измерения электропроводности стандартного раствора постоянную сосуда  находят по формуле (3.5):
находят по формуле (3.5):
 .
.
Затем определяют сопротивления исследуемых растворов и вычисляют соответствующие величины 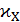 :
:
 . (3.15)
. (3.15)
Каждое измерение повторяют несколько раз, заполняя сосуд новым раствором до тех пор, пока расхождение между предыдущими и последующими измерениями не будет меньше 0,2%. Измерения нельзя продолжать длительное время, чтобы не нагревался раствор в сосуде.