На основании полученных результатов строят график: на оси ординат показания гальванометра, на оси абсцисс – число добавленных миллилитров реагента. По графику определяют эквивалентную точку и рассчитывают концентрацию исследуемого раствора 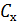 по формуле:
по формуле:
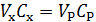 . (5.4)
. (5.4)
Здесь  ,
,  ,
, 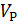 ,
, 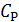 – объемы и концентрации изучаемого раствора и реагента.
– объемы и концентрации изучаемого раствора и реагента.
Отчет включает в себя следующие разделы: теоретическая часть, цель работы, схема титрования, результаты измерений, график кривой титрования, расчет концентрации исследуемого раствора, выводы.
Лабораторная работа 14. Потенциометрическое титрование
Для возможности использования той или иной реакции в потенциометрическом анализе необходимо соблюдение следующих условий:
а) реакция протекает с достаточно большой скоростью, и равновесие устанавливается быстро;
б) отсутствуют побочные процессы;
в) реакция протекает стехиометрически;
г) существует соответствующий индикаторный электрод.
Преимущество потенциометрического метода титрования по сравнению с химическим состоит в том, что он позволяет титровать окрашенные и содержащие осадок растворы и дает возможность одновременно определять несколько элементов.
Цель работы состоит в потенциометрическом определении концентрации:
1) 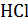 и
и  в смеси их растворов;
в смеси их растворов;
2) ионов хлора и иода в смеси растворов 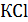 и
и  ;
;
3) соли Мора 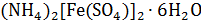 в исследуемом растворе.
в исследуемом растворе.
Экспериментальная часть
Первый вариант. Компенсационное титрование кислоты
Для выполнения потенциометрического титрования составляют цепь, один из электродов которой – насыщенный хлоридсеребряный, а второй – индикаторный электрод, помещаемый в анализируемый раствор. Стакан с анализируемым раствором снабжен мешалкой, лопасти которой должны быть полностью погружены в жидкость во избежание разбрызгивания раствора. Бюретку с реактивом для титрования помещают над стаканом. Хлоридсеребряный и индикаторный электроды соединяют с помощью электролитических ключей с растворами 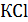 или
или  в зависимости от титруемых растворов.
в зависимости от титруемых растворов.
Схема установки для компенсационного и некомпенсационного потенциометрического титрования представлена на рис. 5.3.
а б
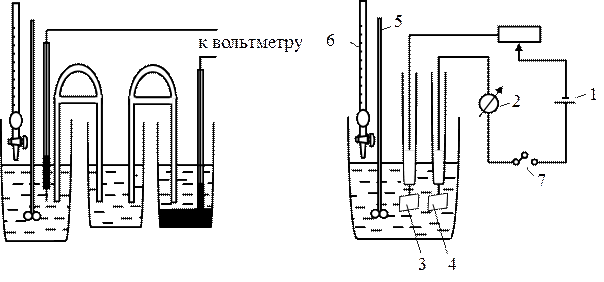
Рис. 5.3. Схема установки для компенсационного (а)
и некомпенсационного (б) титрования:
1 – источник тока; 2 – гальванометр; 3, 4 – платиновые электроды; 5 – мешалка;
6 – бюретка; 7 – ключ
Ход анализа сводится к следующему. Пробу (5 – 10 мл) исследуемого раствора наливают в титровальный стакан и разбавляют дистиллированной водой. После этого в раствор опускают индикаторный электрод и включают мешалку. Затем ведут титрование.
В начале титрования реактив (щелочь) приливают большими порциями (0,5 – 1,0 мл). После каждого прибавления реактива определяют ЭДС элемента либо отношение  . Вблизи эквивалентной точки, когда величина потенциала начнет сравнительно быстро возрастать, реагент приливают небольшими порциями (0,05 – 0,1 мл).
. Вблизи эквивалентной точки, когда величина потенциала начнет сравнительно быстро возрастать, реагент приливают небольшими порциями (0,05 – 0,1 мл).
а б

Рис. 5.4. Кривая потенциометрического титрования (а)и дифференциальная кривой потенциометрического титрования (б):
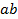 – сильная кислота;
– сильная кислота;  – слабая кислота
– слабая кислота
После каждого добавления реактива, прежде чем определить ЭДС (или точку компенсации), выжидают 2 – 3 мин, чтобы потенциал индикаторного электрода достиг своего равновесного значения. После того как резкое изменение потенциала прекратится, делают 3 – 4 измерения и на этом титрование заканчивают.
Смесь галоидных солей титруют раствором 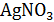 , а раствор соли Мора – перманганатом.
, а раствор соли Мора – перманганатом.
Следует помнить, что применяемый для титрования реактив должен быть в 5 – 10 раз более концентрированным, чем титруемый раствор, чтобы изменение объема раствора было невелико.
Эквивалентную точку, как указывалось выше, определяют по точке перегиба на кривой 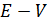 либо по максимуму на дифференциальной кривой титрования
либо по максимуму на дифференциальной кривой титрования 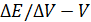 (рис. 5.4, а и б).
(рис. 5.4, а и б).
Второй вариант. Дифференциальное титрование кислоты и смеси галоидных солей.
Дифференциальный метод потенциометрического титрования позволяет определять точку эквивалентности (максимум величины 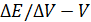 ) непосредственно. Этот метод состоит в том, что в часть титруемого раствора, отделенную от основной массы, помещают один индикаторный электрод, а в остальную часть раствора – второй такой же. Затем определяют разность потенциалов между двумя одинаковыми индикаторными электродами при титровании. Эта разность потенциалов возникает вследствие изменения концентрации основной массы титруемого раствора по сравнению с выделенной. В качестве индикаторных электродов применяют при титровании кислоты – хингидронные, при титровании смеси
) непосредственно. Этот метод состоит в том, что в часть титруемого раствора, отделенную от основной массы, помещают один индикаторный электрод, а в остальную часть раствора – второй такой же. Затем определяют разность потенциалов между двумя одинаковыми индикаторными электродами при титровании. Эта разность потенциалов возникает вследствие изменения концентрации основной массы титруемого раствора по сравнению с выделенной. В качестве индикаторных электродов применяют при титровании кислоты – хингидронные, при титровании смеси 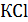 и
и 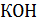 – серебряные.
– серебряные.
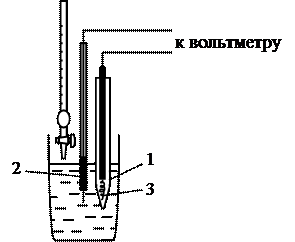
Рис. 5.5. Схема установки для дифференциального титрования:
1 – трубка; 2 – электрод сравнения;
3 – платиновая проволока – индикаторный электрод
Практически, второй индикаторный электрод изолируют от основного раствора с помощью стеклянной трубочки (рис. 5.5)с пипеткой. После каждого измерения раствор под колпаком пипеткой перемешивают с основной массой раствора.
В точке эквивалентности разность потенциалов между двумя индикаторными электродами максимальна. Ход титрования аналогичен предыдущему. После окончания титрования строят график 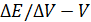 и находят концентрацию исследуемого раствора.
и находят концентрацию исследуемого раствора.
Метод дифференциального титрования проще обычного компенсационного.
Третий вариант. Некомпенсационное титрование
При некомпенсационном методе титрования нет необходимости определять изменение потенциала индикаторного электрода в ходе титрования и строить кривые титрования. Точка эквивалентности при этом определяется по резкому отклонению стрелки гальванометра. Метод характеризуется простотой аппаратурного оформления и быстротой определения. Однако зависимость величины потенциала индикаторного электрода от посторонних ионов, обычно содержащихся в исследуемом электролите, накладывает ряд ограничений на использование этого метода. Наиболее известные разновидности некомпенсационного метода – титрование до нуля и титрование с биметаллическими электродами. Рассмотрим метод титрования до нуля.
При этом методе в качестве электрода сравнения применяют электрод, потенциал которого приблизительно равен потенциалу индикаторного электрода в эквивалентной точке. Точного равенства потенциалов этих электродов не требуется, так как по достижении точки эквивалентности наблюдается резкий скачок потенциала индикаторного электрода. Так, например, при титровании кислот с хингидронным электродом в качестве электрода сравнения может быть применен хлоридсеребряный электрод, при титровании 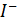 азотнокислым серебром – бромсеребряный электрод в растворе
азотнокислым серебром – бромсеребряный электрод в растворе 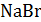
(1,0 моль-экв/л).
Схема установки для титрования приведена на рис. 5.4. Титрование проводят при непрерывном перемешивании раствора. По мере приближения к эквивалентной точке наблюдается все меньшее отклонение стрелки гальванометра и, наконец, при избытке реагента стрелка гальванометра будет резко устойчиво отклоняться в противоположную сторону. Если в цепь включить аккумулятор (рис. 5.6, а), то точность определения может быть повышена.
а б

Рис. 5.6. Схема установки для титрования до нуля:
а – некомпенсационная; б – с включенной навстречу ЭДС.
Метод титрования до нуля может проводиться с обычным хлоридсеребряным электродом сравнения без подбора специального компенсационного электрода сравнения. В этом случае с помощью потенциометра навстречу ЭДС исследуемой ячейки подается разность потенциалов, численно равная ЭДС ячейки в эквивалентной точке. Титрование ведут до тех пор, пока при кратковременном замыкании цепи гальванометр не покажет отсутствие тока в цепи либо стрелка его начнет отклоняться в другую сторону (рис. 5.6, б).
Примером некомпенсационного титрования до нуля может служить титрование 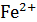 перманганатом:
перманганатом:
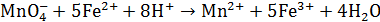 . (5.5)
. (5.5)
В эквивалентной точке при 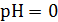 , когда
, когда  и
и
 , устанавливается окислительно-восстановительный потенциал, равный
, устанавливается окислительно-восстановительный потенциал, равный
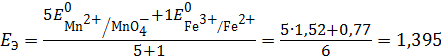 В. (5.6)
В. (5.6)
Измерительную цепь составляют из индикаторного электрода (гладкая платина) и хлоридсеребряного электрода сравнения. Навстречу ячейке с помощью потенциометра включают разность потенциалов, равную
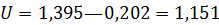 В,
В,
где 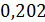 – потенциал насыщенного хлоридсеребряного электрода.
– потенциал насыщенного хлоридсеребряного электрода.
Для титрования берут 20 мл 0,1 моль-экв/л 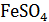 , прибавив 40 мл. 2,0 моль-экв/л
, прибавив 40 мл. 2,0 моль-экв/л 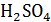 , титруют раствор 0,1 моль-экв/л
, титруют раствор 0,1 моль-экв/л 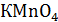 .
.
В качестве вариантов может быть осуществлено некомпенсационное титрование кислот, определение ионов 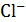 ,
, 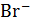 ,
, 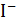 ,
, 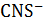 .
.
Четвертый вариант. Метод титрования с биметаллическими электродами
Метод основан на том, что потенциалы некоторых инертных электродов не зависят от изменения состава электролита в эквивалентной точке. Такие электроды можно использовать как своеобразные электроды сравнения. Материалом для них служат палладий, вольфрам, графит, карборунд. Индикаторным является платиновый электрод.
Метод может быть использован, например, при окислительно-восстановительном титровании:
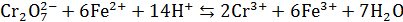 . (5.7)
. (5.7)
Для титрования собирают установку, схема которой аналогична показанной на рис. 5.5 и 5.6. В цепь электролитической ячейки потенциометрически включают аккумулятор и последовательно высокоомное сопротивление (10 – 20 кОм), что позволяет увеличить отклонение стрелки гальванометра в эквивалентной точке.
Ячейка для титрования составлена из платинового и вольфрамового электродов (проволоки), раствор перемешивают мешалкой. Для титрования берут 20 – 25 мл 0,1 моль-экв/л 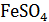 , добавляют 25 мл
, добавляют 25 мл 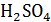 (1: 3) и разбавляют водой до 150 мл. Приготовленный раствор титруют 0,1 моль-экв/л раствором
(1: 3) и разбавляют водой до 150 мл. Приготовленный раствор титруют 0,1 моль-экв/л раствором 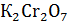 , наблюдая в момент кратковременного размыкания ключа за стрелкой гальванометра. В начале титрования стрелка гальванометра остается почти неподвижной. По мере приближения к эквивалентной точке она постепенно отклоняется от первоначального положения, а в точке эквивалентности наблюдается резкий скачок.
, наблюдая в момент кратковременного размыкания ключа за стрелкой гальванометра. В начале титрования стрелка гальванометра остается почти неподвижной. По мере приближения к эквивалентной точке она постепенно отклоняется от первоначального положения, а в точке эквивалентности наблюдается резкий скачок.
После перехода к точке эквивалентности стрелка постепенно возвращается в первоначальное положение.
Разница в поведении двух электродов объясняется тем, что платина быстро приходит в равновесие с окислительно-восстановительной системой, в то время как вольфрам (инертный электрод) приходит в равновесие с раствором чрезвычайно медленно.
Оформление отчета
Отчет включает в себя следующие разделы: теоретическая часть, цель работы, схема титрования, результаты измерений, график кривой титрования, расчет концентрации исследуемого раствора, выводы