Лекция 4 Производство низших ненасыщенных углеводородов: этилен и пропилен. Промышленные синтезы на основе этилена и пропилена. Технология процессов пиролиза и крекинга. Пиролиз и крекинг тяжелого нефтяного сырья. Высокотемпературный пиролиз мазута. Подготовка газа к разделению. Технологическая схема разделения газов при пиролизе бензина.
Лекция 5 Разделение газов пиролиза и выделение концентрированного этилена и пропилена. Аппаратурное оформление процесса пиролиза. Пиролиз в трубчатых печах.
Олефины, используемые в качестве исходных веществ для основного органического и нефтехимического синтеза, можно разделить на две основные группы: 1) низшие газообразные или низкокипящие олефины от этилена до пентенов (С2—C5) и 2) высшие олефины от С6 до C12—C18 (главным образом С7—C15),
Таблица 1 - Свойства низших олефинов
| Олефин | Температура конденсации, ºС | Критическая температура, ºС | Критическое давление, МПа | Пределы взрывоопасных концентраций в смеси с воздухом, % (об.) |
| Этилен | — 103,7 | 9,9 | 4,95 | 3,0—32 |
| Пропилен | —47,7 | 91,8 | 4,47 | 2,2—10,0 |
| Бутен-1 | —6,3 | 146,2 | 3,89 | 1,6-9,4 |
| цис-Бутен-2 | +3,7 | 157,0 | 4,02 | 1,6—9,4 |
| транс-Бутен-2 | +0,9 | — | — | 1,6-9,4 |
| Изобутен | —7,0 | 144,7 | 3,85 | 1,8-9,6 |
| Н-Пентены | 30—37 | — | — | 1,3—8,8 |
| Изопентены | 20,1-38,6 | — | — | 1,3-8,8 |
обычно представляющие собой не индивидуальные вещества, а смеси изомеров и гомологов.
Низшие олефины.Олефины от этилена до бутенов при обычных условиях являются газами, пентены С5Н10—низкокипящими бесцветными жидкостями. Некоторые свойства этих углеводородов приведены в табл. 3. Из данных по критической температуре ясно, что этилен можно превратить в жидкость только при низких температурах и высоких давлениях, охладив, например, кипящим аммиаком. Другие газообразные олефины сжижаются под давлением уже при охлаждении водой. При сравнении олефинов с соответствующими парафинами видно, что этилен кипит ниже этана на 15 °С, а пропилен — ниже пропана на 5,5 °С. Это очень важно для процессов переработки, когда этилен (и с большей трудностью — пропилен) отделяют от соответствующих парафинов ректификацией. Температуры кипения бутенов и бутанов очень близки, и для их разделения простая ректификация не пригодна.
Все низшие олефины дают с воздухом взрывоопасные смеси, вследствие чего цеха, производящие или потребляющие эти углеводороды, относятся по своей пожароопасности к категории А. По токсичности олефины близки к насыщенным углеводородам (вызывают при вдыхании паров наркотические явления); их предельно допустимая концентрация в атмосфере производственных помещений такая же, как у соответствующих парафинов.
Важными отличиями олефинов от парафинов с тем же числом атомов углерода являются более высокая растворимость и способность сорбироваться, обусловленная наличием ненасыщенной углерод-углеродной связи. Олефины лучше, чем парафины, адсорбируются твердыми веществами, поглощаются растворами медноаммиачных комплексов и растворяются в полярных жидкостях, таких как ацетон и фурфурол. Это позволяет выделять их специальными методами, из которых наиболее важное значение приобрела экстрактивная перегонка. Принцип ее состоит в том, что при наличии третьего компонента, имеющего меньшую летучесть и способного к диполь-дипольному взаимодействию или образованию различных комплексов с олефинами, парциальное давление олефинов снижается в большей мере, чем у парафинов. В результате относительная летучесть парафинов, измеряемая отношением давлений насыщенных паров α = ра/рв, значительно возрастает (табл. 2).
Высшие олефины.Олефины С6— С18 являются жидкостями, температура кипения которых зависит от числа атомов углерода и строения цепи. Ниже приведены температуры кипения (в °С) олефинов С6—C12 с прямой цепью:
н-СвН12............. 63,5—68........................ н-С10Н20 170—175
н-С7Н,,............ 93,8—98,2..................... н-С,2Н24 213—218
н-С8Н1в............. 121-126
Таблица 2 - Данные относительной летучести углеводородов С4 в сравнении с бутадиеном-1,3.
| Углеводород | Простая перегонка | Экстрактивная перегонка | Хемосорбция растворами медных солей* | |
| С фурфуролом | С ацетонитрилом | |||
| Изобутан | 1,209 | 2,600 | - | - |
| Изобутен | 1,070 | 1,666 | 1,58 | |
| Бутен-1 | 1,046 | 1,718 | 1,56 | |
| Бутадиен-1,3 | 1,000 | 1,000 | 1,00 | 1,00 |
| Н-Бутан | 0,871 | 2,020 | - | - |
| транс-Бутен-2 | 0,843 | 1,190 | 1,34 | |
| цис-Буен-2 | 0,776 | 1,065 | 1,28 | |
| *При хемосорбции водными растворами медиоаммиачных комплексов, используемых для очистки фракций С4 от бутадиена-1,3 или для выделения из фракций С4 |
Олефины с разветвленной цепью углеродных атомов кипят при более низкой температуре, чем их изомеры нормального строения.
Ввиду высокой реакционной способности и сравнительной доступности олефины заняли преобладающее место как исходные вещества для органического синтеза. Из них наибольшее значение имеют этилен и пропилен, производство которых в США составляет соответственно около 15 и 7,5 млн. т в год. В меньшем масштабе применяют бутены, высшие олефины и еще меньше изопентены.
Главным методом получения олефинов в промышленности являются процессы расщепления нефтяных фракций или углеводородных газов. Эти процессы можно разделить на две группы: термические (пиролиз и термический крекинг парафинов) и каталитические (каталитический крекинг). Первые осуществляют (Для целевого получения олефинов, а вторые — для производства бензина, и олефины получаются как побочный продукт. Кроме того, часть олефинов получают дегидрированием соответствующих парафинов, а некоторые олефины — реакциями их взаимного превращения (олигомеризация и диспропорционирование) [1].
Теоретические основы процессов крекинга и пиролиза
Термодинамическая стабильность углеводородов
Для оценки возможных превращений углеводородов при переработке важную роль играет их термодинамическая стабильность.
На рис. 1 изображена температурная зависимость изменения энергии Гиббса образования углеводородов С6 разных классов из простых веществ. Энергия Гиббса их взаимного превращения (∆G°), связанная с константой равновесия КР уравнением
ΔGº=RTlnKp
и равная разности ординат соответствующих кривых на рис. 1, является мерой термодинамической возможности осуществления процесса, так как система всегда стремится перейти в состояние с наименьшей энергией Гиббса. Как видно для углеводородов С6, при низкой температуре термодинамическая стабильность углеводородов разных классов при одинаковом числе атомов углерода в молекуле понижается в ряду:
Парафины > Нафтены > Олефины > Ароматические углеводороды.
Однако с ростом температуры ввиду разной зависимости энергии Гиббса от температуры порядок изменяется на обратный:
Ароматические углеводороды > Олефины > Нафтены > Парафины
Таким образом, при термическом воздействии на нефтепродукты следует ожидать изменения группового состава углеводородов. Процесс расщепления (крекинг) парафина может происходить с образованием молекул олефина и парафина с более короткой цепью углеродных атомов, причем обратный процесс представляет собой алкилирование парафина олефином:
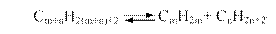
Термодинамическая возможность реакций иллюстрируется температурной зависимостью изменения энергии Гиббса этих реакций (рис. 2). Нетрудно видеть, что примерно до 600 К изменение ∆G0 больше нуля, и, следовательно, расщепление парафинов термодинамически невозможно, а может происходить лишь алкилирование. При более высокой температуре положение меняется на обратное, причем при 800 К и выше расщепление является уже практически необратимым процессом. Существенно, что н-декан и высшие парафины более склонны к расщеплению, чем низшие (кривая 4 лежит ниже кривой 3).
Для олефинов (рис. 2, кривая) склонность к расщеплению проявляется при более высокой температуре, чем для парафинов. В системе обратимых реакций крекинга олефина и его димеризации (полимеризации)

перемена знака в изменении ∆G0 для низших олефинов происходит только при 750—800 К. Это указывает на термодинамическую возможность их полимеризации при термическом и каталитическом крекинге, но с преобладанием расщепления при более высоких температурах.
На рис. 2 (кривая 2) изображена также зависимость изменения ДС при расщеплении молекулы циклогексана на две молекулы пропилена. Из анализа этой кривой следует, что при повышенных температурах (более 650—700 К) расщепление нафтенов с образованием углеводородов с открытой цепью становится возможным.

Рис. 1. Температурная зависимость изменения энергии Гиббса ΔGº образования углеводородов С6 из простых веществ: 1 – н-гексан; 2 – гексен; 3 – циклогексан; 4 – бензол
Рис. 2. Температурная зависимость изменения энергии Гиббса реакций расщепления различных углеводородов:

Известные законы термодинамики позволяют оценить роль давления при термическом расщеплении нефтепродуктов. Повышение давления способствует смещению равновесия в сторону полимеризации олефинов и алкилирования парафинов, поскольку указанные реакции протекают с уменьшением объема. В связи с этим высокое давление препятствует глубокому расщеплению сырья и снижает образование низших углеводородов и особенно олефинов. Очевидно, понижение давления и повышение температуры должны действовать в обратном направлении.
Химические реакции, протекающие при термическом крекинге и пиролизе.Наиболее важной реакцией при термических процессах является расщепление углеводородов по углерод-углеродным связям. В результате этой реакции, а также при дальнейшем расщеплении первичных продуктов образуются газообразные и жидкие смеси насыщенных и ненасыщенных углеводородов:
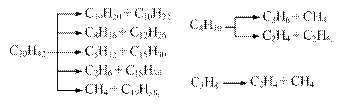
Циклические углеводороды, присутствующие в нефтепродуктах, при тех же условиях отщепляют боковые цепи, а нафтеновые кольца, кроме того, раскрываются с образованием олефинов:
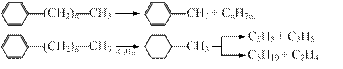
Все перечисленные реакции в отсутствие катализаторов протекают через образование свободных радикалов и имеют цепной характер:

С повышением температуры расщепление идет более глубоко, но дополняется реакциями дегидрирования и циклизации.
Дегидрирование также протекает как радикально-цепной процесс:

В результате дегидрирования при 600—650 °С начинают появляться очень реакционно-способные диены, например бутадиен-1,3:

При взаимодействии диенов с олефинами (диеновый синтез) происходят циклизация углеводородов с прямой цепью и ароматизация образующихся циклоолефинов, а из диенов и циклоолефинов таким путем получают конденсированные ароматические углеводороды, напримернафталин:

Кроме газообразных и жидких веществ при всех высокотемпературных процессах переработки нефтепродуктов и углеводородных газов получаются также твердые вещества — углерод (сажа) или кокс. Образование сажи объясняется распадом углеводородов до свободного углерода, например:

Кокс получается при глубокой конденсации ароматических соединений, идущей с отщеплением водорода (дегидроконденсация):

В результате образуются высококонденсированные нелетучие и нерастворимые вещества, из которых и состоит кокс.
Выход и состав продуктов термического разложения углеводородов.Относительный выход жидких продуктов (бензин и крекинг-остаток или смола пиролиза), газа (крекинг-газ или газ пиролиза) и твердого остатка (кокс или сажа) зависит от трех основных факторов: вида сырья, температуры и времени контакта.
Разные виды сырья различаются по соотношению в нем водорода и углерода: в этане на каждый атом углерода приходится 3 атома водорода, в бутане — 2,5, а циклогексане — 2, в ароматических компонентах — еще меньше. Очевидно, что относительно легкое сырье (углеводородные газы и бензин) даст при расщеплении больше газа и мало кокса; наоборот, из тяжелых нефтепродуктов с высоким содержанием углерода (особенно имеющих много ароматических компонентов) получится значительное количество кокса и меньше газа (рис. 3).
Другим важным фактором, влияющим на выход продуктов, является температура. Термическое расщепление высших углеводородов начинается около 400°С, но достигает значительной скорости лишь при 480—550°С, ускоряясь при дальнейшем повышении температуры. При этом общая закономерность состоит в том, что при прочих равных условиях с повышением

Рис. 3. Выход газа (1), жидких продуктов (2) и кокса (3) при пиролизе (t = 800ºС) различного сырья
Рис. 4 Температурная зависимость выхода газа (1), жидких продуктов (2) и кокса (3) при пиролизе газойля
температуры возрастает выход газа и кокса и снижается выход жидких продуктов (рис. 4).
Главным образом от температуры зависят также состав и выход продуктов. При ее повышении жидкие продукты расщепления все более обогащаются ароматическими соединениями, а газ — водородом и низшими углеводородами. Так, термическое разложение нефтяных фракций при 500—550°С дает смесь жидких веществ, отличающуюся от исходной фракции в основном появлением в них олефинов, а получаемый газ состоит преимущественно из углеводородов С3—С4 с суммарным выходом олефинов 4 % на исходное сырье. Повышение температуры до 750—850°С приводит к тому, что жидкие продукты ароматизируются на 85—95%, а в газе остается все меньше парафинов С2—С4 и он обогащается пропиленом и особенно этиленом. Суммарный выход олефинов С2—С4 на исходное сырье достигает при пиролизе этана и пропана 60—80 % (масс.) и при пиролизе бензина 40—50% (масс). В газообразных продуктах появляются диены и ацетилены, причем выход наиболее ценного бутадиена-1,3 из бензина составляет 4—5%. При дальнейшем повышении температуры выход олефинов, проходя через максимум при 800—900°С, начинает падать и образуется все больше водорода и ацетилена.
Большое влияние на состав продуктов термического расщепления оказывает также время контакта. Поскольку образование водорода, метана, ароматических соединений и кокса, а также полимеризация олефинов являются последовательными по отношению к первичному расщеплению сырья, то при прочих равных условиях увеличение времени контакта ведет к усиленному развитию этих процессов и к снижению выхода олефинов. Примерно так же влияет давление: при его уменьшении полимеризация и конденсация первичных продуктов замедляются и растет выход олефинов.
В зависимости от целевого назначения процесса соответствующим образом подбирают сырье, температуру, время контакта и давление. Так, нефтяной кокс получают из тяжелых остатков под давлением при 500—550 °С и большой продолжительности реакции. Для целевого получения жидких продуктов (бензин или α-олефины) используют средние фракции нефти, проводя процесс при 500—550°С и времени контакта, обеспечивающем лишь частичное превращение сырья с рециркуляцией его непревращенной части. Наконец, пиролиз, который предназначен для получения низших олефинов, проводят при 800— 900°С, малом времени контакта (0,2—0,5 с) и разбавлении сырья водяным паром. Выбор сырья для пиролиза очень широк— от этана до сырой нефти, но наблюдается тенденция к переходу от углеводородных газов к прямогонным бензиновым фракциям, дающим повышенный выход бутадиена-1,3 и ароматических углеводородов — ценных побочных продуктов пиролиза. Другая тенденция состоит в дальнейшем уменьшении времени контакта (0,1 с и ниже) и развитии так называемого «миллисекундного пиролиза». При пиролизе более тяжелых фракций нефти перспективен гидропиролиз, проводимый в присутствии водорода; Н2 препятствует образованию кокса и тяжелых остатков, приводя к повышению выхода олефинов и бутадиена-1,3.
Каталитический крекинг. При каталитическом крекинге расщепление углеводородов осуществляется на алюмосиликатах — типичных катализаторах ионных реакций. В их присутствии реакции расщепления идут не по свободнорадикальному механизму, как при термическом крекинге, а по ионному, через промежуточную стадию положительно заряженных карбокатионов. Последние образуются из олефинов, которые получаются хотя бы в небольшом количестве при термическом распаде сырья, и протонов, генерируемых катализатором кислотного типа:

Карбокатионы не стабильны и способны распадаться на молекулу олефина и карбокатион с более короткой углеродной цепью. Кроме того, они могут отнимать водород в виде гидрид-иона от других нейтральных молекул, также превращая их в карбокатионы. Благодаря этому развивается ионно-цепной процесс расщепления парафинов:

В отличие от свободных радикалов карбокатионы легко изо-меризуются, о чем уже говорилось раньше. Вследствие этого в бензине каталитического крекинга содержится много изопарафинов, имеющих более высокое октановое число по сравнению с н-парафинами. Этот эффект еще более усиливается из-за повышенного содержания ароматических углеводородов, которые образуются за счет каталитического перераспределения водорода между молекулами олефина и нафтена. Например,

Состав газов каталитического и термического крекинга также различен. При каталитическом крекинге расщепление углеводородов до соединений с одним или двумя углеродными атомами протекает лишь в небольшой степени, так как карбокатионы СН3 и С2Н5 мало стабильны. Поэтому в газах каталитического крекинга преобладают углеводороды С3 и С4, но в то же время в них содержится больше водорода, чем в газах термического крекинга. Выход газа при каталитическом крекинге составляет 10—15% (масс)[1].
Технология процессов пиролиза
Процесс пиролиза является эндотермическим и относится к числу очень энергоемких производств, в котором важное значение имеет утилизация тепла горячих газов. Существующие схемы реакционных узлов различаются способом подвода тепла: внешний обогрев топочными газами, при помощи высокоперегретого водяного пара (гомогенный или адиабатический пиролиз), частичное сгорание сырья при подаче кислорода (окислительный пиролиз) и нагревание неподвижным или перемещающимся твердым теплоносителем (регенеративный пиролиз).
Наиболее распространенным методом является пиролиз с внешним обогревом. Основным реакционным аппаратом является трубчатая печь, используемая и в других процессах нефтепереработки и нефтехимии. Сырье перемещается в печи по трубам. которые обогреваются за счет тепла, получаемого при сгорании газообразного или жидкого топлива. Во избежание чрезмерного образования продуктов уплотнения сырье разбавляют водяным паром до 50% (масс). Несмотря на это в трубах постепенно накапливается кокс, и для его удаления печи периодически останавливают и очищают.
Вместо устаревших печей малой производительности (4— 6 тыс. т этилена в год) теперь применяют более мощные агрегаты, отличающиеся высоким теплонапряжением, жестким режимом работы и малым временем пребывания сырья. В старых печах пиролиз проводился при температуре 700—750°С, что не позволяло достичь высокого выхода наиболее ценного продукта — этилена. Сейчас процесс пиролиза осуществляют в «этиленовом режиме», т. е. при 850—870 СС. Из других усовершенствований следует отметить применение панельных беспламенных горелок, вертикальное расположение труб, их двухсторонний обогрев, блокирование в одном корпусе нескольких топочных камер большого размера, градиентный способ обогрева, при котором на каждом участке труб создается оптимальная температура, соответствующая протекающей в данном месте стадии пиролиза. Все это позволило увеличить мощность трубчатой печи до 50 и более тыс. т этилена в год и создать установки по производству олефинов мощностью 300—450 тыс. т этилена в год.

Рис. 5. Схема печи пиролиза: 1 – корпус; 2 – панельные горелки; 2 – радиантные камеры; 4 – вертикальные трубы; 5 – конвекционная камера
Схема одной из современных трубчатых печей пиролиза представлена на рис. 5. Газообразное или жидкое топливо сгорает в панельных горелках 2, расположенных в системе каналов и керамической кладке (панели) печи. В топочных камерах находится радиантная секция 3, состоящая из вертикальных труб, обогреваемых за счет наиболее эффективной теплопередачи излучением от раскаленной панели печи и топочных газов. В этой части труб и протекает непосредственно пиролиз, здесь поддерживается наиболее жесткий температурный режим. Частично охлажденные топочные газы поступают затем в конвекционную камеру 5, где теплопередача осуществляется за счет менее эффективной конвекции тепла. В расположенной здесь секции труб сырье и пар-разбавитель нагреваются до необходимой температуры, после чего они поступают в радиантную секцию труб и продукты пиролиза уходят из печи на дальнейшую переработку. Топочный газ направляется на утилизацию его тепла и затем выводится в атмосферу.
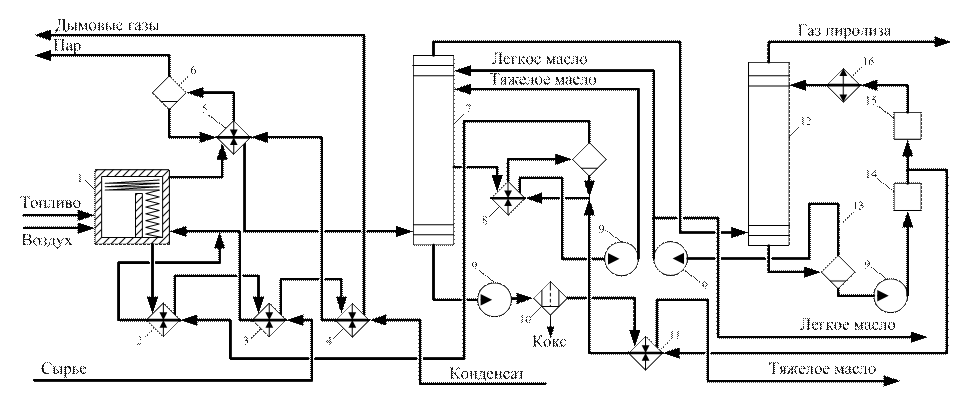
Рис. 6. Технологическая схема пиролиза бензина: 1 – печь пиролиза; 2-4, 11 – теплообменники; 5,8 – котлы-утилизаторы; 6 – паросборник; 7 – колонна тяжелой фракции; 9 – насосы; 10 – фильтр; 12 – колонна легкой фракции; 13 – сепаратор; 14 – блок очистки оборотной воды; 15 – блок рекуперации тепла оборотной воды; 16 - холодильник
Современные установки пиролиза отличаются большой мощностью и высокой степенью утилизации тепла дымовых газов и продуктов пиролиза. Технологическая схема одной из них изображена на рис. 6. Пиролиз осуществляется в трубчатой печи 1, вгорелки которой подают топливо и воздух. Тепло топочных газов после их выхода из конвекционной секции используется в теплообменниках 2, 3 и 4 соответственно для перегрева водяного пара, идущего на пиролиз, испарения и перегрева углеводородного сырья и нагревания водного конденсата, используемого для получения пара. После этого топочные газы через дымовую трубу выводятся в атмосферу.
Продукты пиролиза выходят из трубчатой печи с температурой 850—870°С. Во избежание полимеризации олефинов и осмоления их нужно быстро охладить до 500—700 С, т. е. подвергнуть «закалке». Ранее для этой цели служили закалочные аппараты, в которых быстрое охлаждение достигалось за счет впрыскивания водного конденсата. Теперь применяют закалочно-испарительные аппараты (ЗИА), представляющие собой газотрубные котлы-утилизаторы (аппарат 5). В результате высокой линейной скорости продуктов пиролиза, движущихся по трубам, предотвращается оседание твердых частиц на стенках, увеличивается коэффициент теплопередачи и достигается быстрое охлаждение до 350—400 °С. За счет этого тепла из водного конденсата, поступающего в ЗИА, генерируется пар высокого давления (11 —13 МПа), который отделяется в паросборнике 6, перегревается до 450 °С в одной из секций печи и затем используется для привода турбокомпрессоров.
Частично охлажденные продукты пиролиза направляются в колонну первичного фракционирования 7, которая орошается легким маслом и тяжелым циркулирующим маслом. За счет испарения первого масла и нагревания второго продукты пиролиза охлаждаются до 100—120°С; из них конденсируется тяжелое масло, которое в нижней части колонны 7 улавливает сажу и кокс. Из этой смеси отделяется кокс в фильтре 10, а тепло тяжелого масла (фильтрата) используется в теплообменнике II для подогрева оборотной воды. Циркулирующее тяжелое масло отводят с одной из нижних тарелок колонны 7, и его тепло утилизируют для получения пара в котле-утилизаторе 8 с паросборником 6. Полученный пар перегревают в теплообменнике 2, и он служит для разбавления углеводородного сырья при пиролизе. Циркулирующее масло после котла-утилизатора 8 закачивают на орошение колонны 7.
Охлажденные до 100—120°С продукты пиролиза вместе с водяным паром-разбавителем направляются в колонну 12, орошаемую охлажденной водой. В результате этого из газа пиролиза конденсируются вода и так называемое легкое масло, а газ пиролиза выводится на установку разделения. Легкое масло отстаивается от воды в сепараторе 13, частично направляется па орошение колонны 7, а остальное количество выводится с установки на дальнейшую переработку.
Горячая вода из сепаратора 13 проходит узел очистки 14, после чего часть ее через теплообменник возвращается в котел-утилизатор 8 и затем в виде пара идет на пиролиз. Другая часть воды направляется в системы утилизации ее тепла 15 (например, отопление помещений, подогрев технологических потоков), дополнительно охлаждается в холодильнике 16 и возвращается на орошение в аппарат 12 [1].
Пиролиз углеводородного сырья в расплавленных средах
Среди перспективных способов термической переработки углеводородов следует назвать пиролиз углеводородных фракций в расплавленных средах. Его достоинства - возможность переработки практически любых видов сырья от легких углеводородных газов до тяжелых жидких фракций (вакуумный газойль, сырая нефть); высокоэффективная теплопередача, обусловленная непосредственным контактом сырья с расплавом и высокоразвитой поверхностью теплообмена; простота непрерывной эвакуации из реакционной зоны твердых продуктов распада (сажи, кокса), благодаря чему отпадает необходимость в периодических остановках реактора для выжига кокса.
В качестве расплава употребляют некоторые металлы (свинец, висмут, кадмий, олово и др.) и их сплавы, соли — хлориды, карбонаты и др. - или многокомпонентные солевые расплавы, а также шлаковые (оксидные) расплавы. Металлические расплавы обладают высокой теплопроводностью, малой вязкостью, но они интенсивно окисляются и относительно дороги. Солевые расплавы не имеют основного недостатка металлических - интенсивной окисляемости, но по сравнению с металлами обладают меньшей теплопроводностью, а некоторые - высокой летучестью и термической нестабильностью, что осложняет сепарацию и регенерацию расплавов. Относительно дешевые шлаковые расплавы характеризуются высокими температурами плавления, не слишком высокой вязкостью, повышенным агрессивным воздействием на конструкционные материалы, поэтому их применяют редко[2, 191 с.].
Способы контактирования перерабатываемых углеводородов с расплавами различны — барботаж через слой расплава, переработка в дисперсии расплавленной среды или при пленочном течении расплава. По способу подвода к сырью тепла расплавы могут служить теплоносителями либо тепло может передаваться в реакционную зону извне аналогично процессу пиролиза в трубчатых печах. Разрабатывался барботажный и в дальнейшем дисперсионный в системе газлифта процесс пиролиза с использованием расплавов солей.
Изучали способ переработки углеводородов в диспергированной расплавленной среде (свинец), циркулирующей по принципу газлифта, причем транспортирующим агентом служило исходное сырье, а теплоноситель циркулировал по замкнутому циклу. Результаты пиролиза пропана, н-гептана, легкого прямогонного бензина (50 -142°С) и сырой бакинской нефти с добавлением 40% водяного пара представлены в таблице 4.
Таблица 4 - Результаты пиролиза пропана, н-гептана, легкого прямогонного бензина (50 -142°С) и сырой бакинской нефти с добавлением 40% водяного пара
| Продукт | Пропан | Н-гептана | Бензин | Сырая нефть |
| Н2 СН4 С2Н6 С2Н4 С3Н8 С3Н6 С4Н10 С4Н8 С4Н6 Жидкие продукты Кокс | 1,41 31,63 4,65 42,5 5,33 10,01 - - - - 4,47 | 0,27 13,25 9,13 42,28 0,77 19,8 0,16 6,11 3,62 1,03 3,48 | 1,11 20,49 3,89 34,71 0,23 10,02 0,08 2,26 4,76 5,6 16,85 | 0,77 14,52 3,76 29,8 0,27 11,35 0,13 2,13 4,2 5,81 27,26 |
При пиролизе в дисперсии расплавленного теплоносителя могут быть получены высокие выходы этилена, но выходы пропилена ниже, чем при термическом пиролизе. Образуется также значительное количество кокса, который, однако, при соответствующем конструктивном оформлении, можно выводить из реакционной зоны, сохраняя непрерывность процесса. Пиролиз в присутствии расплавленных теплоносителей был проверен в условиях укрупненной опытно-промышленной установки, и полученные результаты достаточно хорошо совпадают с лабораторными[2, 192 с.].
Более высокая степень смешения углеводородов со средой и ускорение теплопередачи достигаются ведением процесса в потоке нагретых паров теплоносителя. Агрегат для пиролиза углеводородов в среде нагретых конденсирующихся паров теплоносителя выполнен в виде замкнутой циркуляционной системы. Пары теплоносителя из испарителя поступают в зону реакции, где, конденсируясь, сообщают необходимое тепло сырью. Теплоноситель отделяется от продуктов пиролиза в сепараторе и возвращается в испаритель. Пиролиз в потоке
конденсирующихся паров теплоносителя характеризуется значительно меньшим коксообразованием по сравнению с процессом в среде диспергированного теплоносителя.
Способ пиролиза и метод закалки продуктов пиролиза в аппаратах с жидким теплоносителем разработаны в Энергетическом институте им. Г. М. Кржижановского. В их основу положен принцип, так называемой, «острой струи», образующейся при вдувании струи газа — углеводородного сырья на поверхность расплава, где при этом получается гидродинамическая впадина (лунка), в которой интенсивно протекают тепло- и массообмен. В аппарате с жидким теплоносителем (свинцом) в интервале температур реакции 640-950°С найдено, что при пиролизе прямогонного бензина могут быть получены выходы этилена до 38%, при пиролизе сырой нефти - до 22% из нефти образуются также 20-30% твердых продуктов (сажа и кокс).
Недостатками пиролиза углеводородного сырья в присутствии расплавленного теплоносителя являются необходимость нагрева и циркуляции теплоносителя, а также сложность от деления его от продуктов реакции. Этих недостатков лишены способы пиролиза углеводородов в присутствии расплавов, но с внешним подводом тепла, например пиролиз в трубчатых печах с дисперсионным или дисперсионно-кольцевым течением расплава. Расплав в этих процессах улучшает теплопередачу между разогретой стенкой реактора и потоком и замедляет (или предотвращает в случае дисперсионно-кольцевого течение при наличии пленки расплава па стенке реактора) отложения кокса в зоне реакции [2, 193 с.].
Разработан процесс (под фирменным названием «Космос» фирма «Mitsui Petrochemical», Япония) пиролиза углеводородов в расплаве солей в трубчатых печах с внешним обогревом. В качестве расплава солей используют эвтектическую смесь, состоящую из Na2СО3, K2CO3 и Li2СО3, с низкой температурой плавления и относительно высокой термостойкостью. В схеме процесса применяют обычную трубчатую печь, снабженную системой циркуляции расплава солей (рис. 7).

Рис. 7. Схема процесса пиролиза «Космос»: 1- реакционный узел; 2 – трубчатая печь; 3 – закалочно-испарительный аппарат; 4 – сепаратор; 5 – емкость для расплава; 6 – насос
Внутренние стенки реактора покрыты пленкой расплава, движущегося в дисперсионно-кольцевом режиме в одном направлении с потоком сырья, поэтому кокс на них не отлагается. В реакционных змеевиках из испытанных материалов можно перерабатывать лишь малосернистые нефти с содержанием серы не более 0,2 %, чтобы избежать коррозии аппаратуры. В таблице 5 приведены выходы основных продуктов пиролиза бензина прямой перегонки и сырой нефти месторождения Тачинг (КНР) в процессе «Космос». Условия пиролиза: расход сырья 3 кг/ч, температура стенки змеевика на выходе 800°С, отношение пар: сырье 1,33, расплав: сырье 2,0, время пребывания 0,55-0,6 с.
Таблица 5 - Выходы основных продуктов пиролиза бензина прямой перегонки и сырой нефти месторождения Тачинг (КНР) в процессе «Космос»
| Пиролиз бензина | |||
| компонент | выход, % | компонент | выход, % |
| Н2 СН4 С2Н2 С2Н4 С2Н6 | 1,12 11,55 0,54 27,79 2,29 | С3Н6 С3Н8 С4 СО СО2 | 16,63 0,31 11,37 0,20 1,68 |
| Пиролиз сырой нефти | |||
| компонент | выход, % | компонент | выход, % |
| Н2 СН4 С2Н2 С2Н4 С2Н6 | 2,09 12,48 0,3 25,19 2,21 | С3Н6 С3Н8 С4 СО СО2 | 11,19 0,16 6,65 1,30 15,3 |
Процессу «Космос» свойствен ряд недостатков: высокое содержание СО и СО2 в продуктах пиролиза, относительно низкая теплопроводность солевой пленки расплава, значительная кратность циркуляции расплава и повышенный расход пара. Эти недостатки могут быть устранены, если в качестве расплава использовать металлы или смеси на их основе (например, свинец и смеси на его основе). Движение расплава осуществляется в дисперсионно-кольцевом режиме. На поверхности реактора образуется пленка металлического расплава толщиной 10-2-10-4 см, которая защищает поверхность змеевика от отложения кокса и улучшает передачу тепла. При этом теплонапряженность поверхности змеевика может быть повышена в 5-7 раз по сравнению с процессами без расплава, что позволит сократить длину змеевика и время пребывания в нем сырья (до 0,05 с), вследствие чего повысится и выход целевых продуктов. Например, выход этилена при пиролизе прямогонного бензина в результате снижения времени пребывания повышается с 26—28 до 41%. Отрицательные моменты пиролиза с данным расплавом обусловлены недостатками применения металлов в качестве расплава, сложностью отделения расплавленных металлов от продукта пиролиза[2, c.194].
Термический крекинг
Термический крекинг твердого или мягкого парафина применяют в промышленности для целевого получения жидких олефинов с прямой цепью из 5—20 атомов углерода. По технологии это производство во многом аналогично пиролизу и термическому крекингу нефтепродуктов. Расщепление также осуществляется в трубчатой печипри температуре 550°С, когда еще не протекают глубокие процессы конденсации и ароматизации. Для повышения выхода олефинов рекомендуется применять водяной пар. Во избежание вторичных реакций крекинг прово