Классификация
Различают врождённые (конституциональные) и приобретённые формы гипопластических анемий. Врождённые Гипопластические анемии встречаются сравнительно редко. В зависимости от характера угнетения кроветворения выделяют формы с поражением всех трёх ростков (истинная гипопластическая анемия) или только эритропоэза (парциальная гипопластическая анемия). Иногда выделяют гипопластическую анемию с гемолитическим компонентом, но некоторые авторы считают, что она представляет собой гипопластическую стадию пароксизмальной ночной гемоглобинури.
История
В 1888 год П. Эрлих описал заболевание у молодой женщины, при котором остро развилась кровоточивость, лихорадка, глубокая анемия и лейкопения (тромбоциты в то время не подсчитывали); на вскрытии отсутствовали признаки кроветворения в костном мозге, что П. Эрлих объяснял первичным угнетением его функции. Термин «апластическая анемия» впервые предложил Шоффар (А. М. Chauffard, 1904). В дальнейшем была выделена апластическая анемия типа Эрлиха, при которой наряду с неуклонно прогрессирующей панцитопенией, нередко осложнённой сепсисом, резко выраженными геморрагиями и некротическими явлениями, гистологически в костном мозге не выявлялись признаки кроветворения; болезнь наблюдалась у лиц в возрасте от 18 до 20 лет. Сходное заболевание под названием «геморрагическая алейкия» описал Франк (Е. Frank, 1915). С введением в практику в 1927 г. М. И. Аринкиным пункционного исследования костного мозга появилась возможность отличать истинные Гипопластическая анемия от панцитопений, обусловленных лейкозным или метастатическим поражением костного мозга. В отечественной литературе первые описания Гипопластическая анемия под названием «клинико-гематологический синдром» принадлежат Г. П. Хосроеву (1913). Гипопластическая анемия как отдельной нозологический форме посвящены работы X. X. Владоса (1937), Е. А. Кост (1952), И. А. Кассирского и Г. А. Алексеева (1962), Ф. Э. Файнштейна (1965), Г. С. Мухамедзяновой (1970) и другие.
Этиология
Гипоплазия кроветворения может быть обусловлена воздействием разнообразных внешних факторов, которые принято делить на две группы: 1) факторы с облигатным миелотоксическим эффектом, пропорциональным величине дозы, — ионизирующая радиация, бензол и его производные (развивается бензольная анемия), противоопухолевые препараты (хлорэтиламины; фосфорамиды; антиметаболиты — антагонисты фолиевой к-ты, аналоги пуринов, пиримидинов и другие; антимитотические средства — колхицин, алкалоиды барвинка; антибиотики — брунеомицин, рубомицин, адриамицин, карминомицин), неорганические соединения мышьяка, эстрогены и другие; 2) факторы с факультативным миелотоксическим эффектом, обнаруживаемым лишь в единичных случаях — антибактериальные, противосудорожные, антитиреоидные, антигистаминные препараты, транквилизаторы (развивается апластическая постмедикаментозная анемия), инсектициды и другие; прямой связи развития Гипопластическая анемия с дозой и длительностью применения препарата в этих случаях не отмечается.
Ко второй группе должны быть отнесены сравнительно редкие случаи развития гипопластической анемии при туберкулёзе, беременности.
Из факторов с факультативным миелотоксическим эффектом наиболее опасен антибиотик левомицетин (хлорамфеникол). По данным Валлерштейна с сотрудники (R. О. Wallerstein, 1969), у лиц, принимающих левомицетин, возможность заболеть гипопластической анемией в 13 раз выше, чем у населения в целом. Реже описывают гипопластическую анемию в связи с приёмом органических соединений мышьяка (мафарсен и другие), противомалярийных препаратов, производных гидантоина, фенилбутазона, солей золота.
Гипопластическую анемию, вызванную воздействием различных внешних факторов, называют миелотоксической анемией. Примерно в 50% случаев гипопластической анемии выявить причину заболевания не удаётся — так называемый идиопатическая форма.
Этиология конституциональной гипопластической анемии (синдрома, или анемии, Фанкони, парциальной гипопластической анемии Джозефса — Даймонда — Блекфена и семейной гипопластическая анемии Эстрена — Дамешека) связана скорее всего с наследованием гена от одного из родителей по рецессивному типу. При цитогенетическом исследовании Блум (G. Е. Bloom) с сотрудники (1966) обнаружили у больных разнообразные хромосомные аберрации в кроветворных клетках. Описаны случаи заболевания детей, родившихся от межродственных браков. Некоторые авторы отмечают сходство синдрома Фанкони с эмбриопатией), вызванной талидомидом.
Патогенез
Развитие гипопластической анемии может быть связано либо с повреждением стволовой клетки, родоначальной для грануло-, эритро- и тромбоцитопоэза, либо с дефектом её микроокружения, препятствующим нормальной жизнедеятельности этой клетки. Обнаружение хромосомных аберраций при врождённой гипопластической анемии, лечебная эффективность трансплантации костного мозга от однояйцовых близнецов, а также малое количество стволовых клеток, выявляемое при культивировании костного мозга больных, подтверждают первое предположение. Редкость возникновения гипопластической анемии под влиянием перечисленных факультативных факторов говорит о роли индивидуального, возможно наследственного, предрасположения. Участие аутоиммунных механизмов предполагается только при парциальной гипопластической анемии, при которой Крантц (S. В. Krantz, 1973) и Л. И. Идельсон с сотрудниками (1976) обнаружили антитела к ядрам эритроцитов. Около 50% случаев парциальной гипопластической анемии развивается у больных, страдающих доброкачественной тимомой; причины этого пока не ясны. При гипопластической анемии дефицита факторов кроветворения не наблюдается. Напротив, содержание их в крови даже повышено вследствие неполного использования уменьшенной по объёму эритропоэтической ткани.
Геморрагические проявления при гипопластической анемии обусловлены нарушением гемостаза в результате глубокой тромбоцитопении и поражения сосудистой стенки. Повышенная проницаемость сосудистой стенки носит вторичный характер и связана с гипоксией, недостатком серотонина. Гистохимические и иммуноморфологические исследования выявляют глубокие структурные нарушения в сосудистой стенке.
Патологическая анатомия
На вскрытии обнаруживают признаки малокровия и дистрофии внутренних органов, обильное отложение жира в подкожной клетчатке, эпикарде, сальнике, множественные геморрагии в коже, слизистых оболочках, серозных покровах, внутренних органах. Иногда отмечают массивные кровоизлияния в головной мозг или мышцу сердца, являющиеся непосредственной причиной смерти. Костный мозг плоских костей бледно-розового или желтоватого цвета, иногда с тёмно-красными участками кровоизлияний. При сдавлении кости с поверхности разреза стекает кровянистая жидкость, богатая жиром. Среди жирового костного мозга могут наблюдаться участки сохранившейся кроветворной ткани. Размеры селезёнки и лимф, узлов часто уменьшены.
| ||
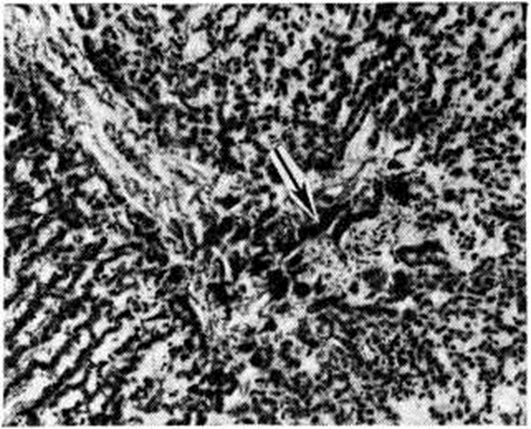
| Микропрепарат печени (гипопластическая анемия): стрелкой указано отложение гемосидерина. |
| ||
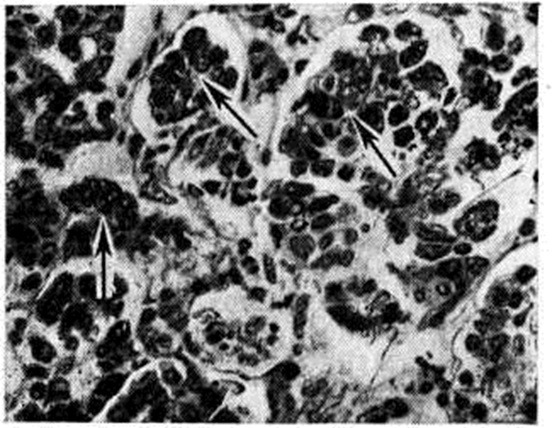
| . Микропрепарат почки (гипопластическая анемия): стрелками указано отложение гемосидерина в эпителии канальцев. |
При микроскопическом исследовании костного мозга выявляется различная степень его опустошения. В случае аплазии в жировом костном мозге находят лишь небольшие скопления лимфоцитов, плазматических клеток и недифференцированных элементов, единичных гранулоцитов и нормобластов. При гипоплазии несколько чаще обнаруживают участки кроветворной ткани. Характерна неравномерность распространения очагов кроветворения не только в различных участках скелета, но и в пределах одной и той же кости. Структура костной ткани чаще сохранена. Как для ранних, так и для поздних фаз болезни характерно отложение гемосидерина в селезёнке, печени (рисунок 1) и костном мозге, реже в почках (рисунок 2), лимфатических, узлах.
К частым осложнениям гипопластической анемии относят фибринозно-геморрагические пневмонии и некротические изменения в слизистых оболочках и серозных покровах, коже, внутренних органах.
Течение и симптомы.
Заболевание может протекать остро, подостро или хронически. В острых случаях процесс начинается с бурного геморрагического диатеза, тяжёлой общей интоксикации, инфекционных осложнений. Чаще наблюдается постепенное нарастание симптомов. Появляются адинамия, слабость, головокружение, быстрая утомляемость, одышка при физической нагрузке, иногда боли в костях и области сердца. Отмечается восковидная бледность кожи без желтушности, малокровие видимых слизистых оболочек. Подкожная жировая клетчатка сохранена. При развитии глубокой тромбоцитогонении возникают кровоизлияния на коже, слизистых оболочках и глазном дне, носовые, десневые, маточные, кишечные, почечные и другие кровотечения. При прогрессировании процесса может иметь место неврологический симптоматика, обусловленная геморрагиями в головной мозг. При парциальной гипопластической анемии кровоточивость отсутствует. Размеры лимфатических узлов, селезёнки и печени не изменяются.
Картина крови. Анемия носит нормохромный, нормоцитарный, реже макроцитарный характер. Полихроматофилия отсутствует, число ретикулоцитов нормально или снижено. Лейкопения может достигать 1000 клеток в 1 микролитров. и менее; она обусловлена в основном гранулоцитопенией и сопровождается относительным лимфоцитозом. Абсолютное число лимфоцитов при резкой лейкопении также снижено. Отмечается тромбоцитопения с удлинением времени кровотечения и снижением ретракции кровяного сгустка. Плазменные факторы свёртывания крови не изменяются. Содержание сывороточного железа повышено, общая железо-связывающая способность сыворотки чаще повышена.
Парциальная гипопластическая анемия характеризуется хронический нормоцитарной анемией, часто без лейко- и тромбоцитопении, с глубокой ретикулоцитопенией.
Пунктат костного мозга, как правило, скудный, ядерные элементы представлены в основном лимфоцитами, немногочисленными гранулоцитами и нормобластами. Мегакариоциты чаще отсутствуют. Иногда, несмотря на явную панцитопению, пунктат оказывается довольно богатым; это связано с попаданием иглы в очаг сохранившегося кроветворения. Помимо чисто количественного дефицита эритробластических элементов, при гипопластической анемии отмечают признаки качественной их патологии (дизэритропоэз), мегалобластоидность, атипичные митозы, многоядерность. При парциальной гипопластической анемии пунктат костного мозга богат ядерными элементами, лейкотромбоцитопоэз не нарушен, но число клеток красного ряда нередко резко уменьшено или они полностью отсутствуют.
| ||
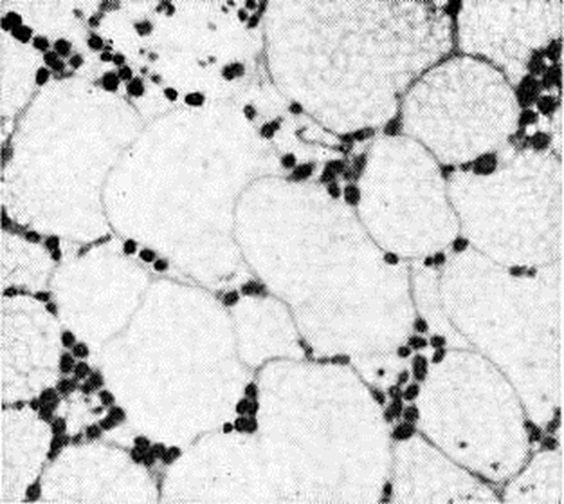
| . Микропрепарат костного мозга подвздошной кости (гипопластическая анемия): резкое преобладание жирового костного мозга над кроветворным. Костномозговые полости заполнены преимущественно жировой тканью, миелоидная ткань представлена маленькими островками чёрного цвета; × 280. |
Трепанобиопсия подвздошной кости выявляет резкое преобладание жирового костного мозга над кроветворным (рисунок 3), иногда отсутствие последнего.
Исследование с радиоактивным железом 59Fe даёт наиболее точную суммарную оценку эритропоэза: клиренс изотопа из плазмы замедлен, он накапливается в основном в печени, включение метки в эритроциты резко замедлено.
Осложнения. Основными осложнениями и непосредственной причиной смерти больных являются кровотечения и инфекционно-воспалительные процессы. Геморрагии выявляются при снижении числа тромбоцитов ниже критического уровня
(20 000—30 000 в 1 микролитров.), могут провоцироваться даже незначительными травмами (подкожные инъекции и так далее). Инфекции (пневмонии и другие) развиваются при достаточно длительном и выраженном (менее 500 в 1 микролитров.) снижении числа нейтрофилов.
Всякая лихорадка у больных гипопластической анемией, как правило, связана с наличием инфекционного очага; описано немало случаев развития у них острого лейкоза. Лейкозы на фоне гипоплазии лучевого или бензольного происхождения относятся к группе миелобластных или миеломонобластных и являются, видимо, поздним результатом лейкемогенного действия фактора, вызвавшего анемию. Значительно реже наблюдается присоединение к гипопластической анемии пароксизмальной ночной гемоглобинурии, хотя некоторые авторы трактуют в этих случаях гипопластическую анемию как гипопластическую стадию данной формы гемолитической анемии.
Диагноз основывается на наличии панцитопении и бедного ядерными клетками пунктата или трепаната костного мозга при отсутствии увеличения лимфатических узлов, селезёнки и печени. Гипопластическую анемию следует дифференцировать главным образом с панцитопениями другого происхождения. Обнаружение в крови молодых клеток белого или красного ряда, даже незначительное увеличение селезёнки всегда должны вызывать сомнение в диагнозе гипопластической анемии. В этих случаях можно предположить наличие алейкемических форм лейкозов, раковых метастазов в костный мозг, миеломной болезни. Диагноз обычно ставят на основании исследования пунктата костного мозга; миеломной болезни, кроме того, присущи характерные изменения белков сыворотки и (или) мочи. Панцитопения при миелофиброзе сопровождается, в отличие от гипопластической анемии, увеличением и миелоидной метаплазией селезёнки. Анемию Аддисона — Бирмера отличает от гипопластической анемии наличие глоссита, неврологический нарушений, ахлоргидрии, выраженного мегалобластоза костного мозга, хорошего терапевтического эффекта от витамина В12. Диагноз пароксизмальной ночной гемоглобинурии даже в её ранней, гипопластической, стадии подтверждается положительными результатами сахарозной и кислотной проб. При подостром варианте лимфогранулематоза панцитопения сопровождается лихорадкой, нет резкого лимфоцитоза, в трепанате костного мозга иногда удаётся обнаружить клетки Березовского — Штернберга. Панцитопения вследствие гиперспленизма сопровождается, как правило, увеличением селезёнки.
Лечение
Методов радикального излечения гипопластической анемии не существует, однако лечебные мероприятия способствуют удлинению продолжительности жизни больных. При выявлении этиологического фактора необходимо прекратить дальнейшее его воздействие. Для борьбы с анемией показаны трансфузии крови или эритроцитарной массы; эта мера не должна преследовать цель полной нормализации показателей красной крови — достаточно поддержание их на уровне, совместимом с сердечно-сосудистой компенсацией. Число трансфузий должно быть минимальным для уменьшения опасности трансфузионного сидероза (при переливании 450 миллилитров крови в организм вводится 200—250 миллиграмм железа), гепатита и других осложнений. Во избежание изосенсибилизации антигенами лейкоцитов и тромбоцитов целесообразно переливать отмытые эритроциты. При многократных гемотрансфузиях нередко развитие изосенсибилизации антигенами эритроцитов; в этих случаях кровь для трансфузии подбирают по непрямой пробе Кумбса.
В случае сочетания анемии с геморрагическим диатезом более выраженным гемостатическим эффектом обладают тромбоцитарные концентраты, получаемые с помощью сепаратора клеток крови от одного донора или путём центрифугирования большого числа доз крови, взятых от различных доноров. Кровоостанавливающее действие тромбоконцентратов проявляется в том случае, если число тромбоцитов у больного удаётся повысить хотя бы до 15 000 —20 000 в 1 микролитров. крови. При многократных переливаниях тромбоцитарных концентратов, особенно полученных из крови разных доноров, неизбежно развивается изосенсибилизация к тромбоцитарным антигенам и отмечается снижение терапевтической эффективности трансфузий. Поэтому желательно в качестве доноров использовать ограниченное число лиц, лучше родственников, максимально совместимых по антигенам системы HL — А.
Среди лекарственных препаратов свойством стимулировать эритропоэз обладают лишь анаболические стероиды. Необходимым условием достижения терапевтического эффекта считают длительность применения гормонов в достаточно высокой дозе. Первым проявлением лечебный эффективности препаратов может быть улучшение показателей периферической крови. При появлении признаков побочного действия (задержка жидкости, поражение печени) гормоны отменяют. Для лечения гипопластической анемии применяют также кортикостероиды (преднизолон 0,5—1,0 миллиграмм на 1 килограмм веса тела или эквивалентные дозы других стероидов) главным образом с целью гемостатического действия (понижение сосудистой проницаемости); для этого используют и другие, так называемый сосудоукрепляющие средства — аскорбиновую кислоту, рутин, препараты кальция. С целью уменьшения гемосидероза органов и тканей можно назначать препараты типа десферала.
Также существуют две теоретические возможности коррекции анемии – замещение недостающего количества стволовых клеток донорскими и снятие ингибиции пролиферации резидуальных стволовых клеток. В первом случае проводят аллогенную трансплантацию костного мозга, во втором – иммуносупрессивную терапию.
Многочисленные попытки пересадки больным донорского костного мозга, предпринимавшиеся без должного иммунологический подбора (только по основным эритроцитарным антигенам), оказались безуспешными, то есть завершились отторжением трансплантата вследствие биологической несовместимости. Случаи подлинной трансплантации немногочисленны. Томас (Е. D. Thomas) с сотрудники (1974) осуществили у четырёх больных с гипопластической анемией успешную пересадку сингенного костного мозга, полученного от однояйцевых близнецов больных, приведшую к полному выздоровлению; операция проводилась без специальной подготовки ввиду антигенной идентичности реципиентов и доноров. Однако подобная возможность является казуистической. Аллогенные пересадки (от доноров, совместимых по системе Н1—А) требуют сложной подготовки реципиентов для предотвращения отторжения трансплантата (общее облучение или введение циклофосфана с целью иммунодепрессии), а также послеоперационного применения цитостатиков для подавления реакции «трансплантат против хозяина» (смотри полный свод знаний Несовместимость иммунологическая). Из 24 больных с гипопластической анемией, описанных Томасом с сотрудниками, 12 прожили свыше 3 месяцев; приживление у них трансплантата было доказано в результате анализа полового хроматина. У больных, получивших ранее многочисленные гемотрансфузии, шансы на приживление трансплантата в связи с образованием изоантител снижаются. Сложность методики пересадки костного мозга делает ее доступной лишь для отдельных специализированных учреждений. ТКМ следует выполнять в максимально ранние сроки всем детям и молодым пациентам, имеющим геноидентичного донора.
Терапия антитимоцитарным глобулином в качестве первой линии стала «золотым стандартом» лечения анемии у молодых пациентов, не подлежащих трансплантации костного мозга, а также у всех пациентов в возрасте старше 40 лет. Эффективность терапии колеблется в пределах 30-70%. Эффективность терапии колеблется в пределах 30-70%. Начало гематологического ответа после терапии антитимоцитарным глобулингом регистрируют в среднем на 8-12 неделях терапии. Вторым препаратом эффективным в лечении анемии, считают циклоспорин А. Он обусловливает селективную супрессию клеточно-опосредованных иммунных реакций. Комбинированную иммуносупрессивную терапию считают терапией выбора для детей с тяжелыми и сверхтяжелыми формами апластических анемий, не имеющих HLA –совместимого родственного донора.
Вопрос об эффективности спленэктомии окончательно не решён. При выраженных геморрагиях операция противопоказана в связи с высокой летальностью. Вероятно, более целесообразна спленэктомия у больных с повышенной секвестрацией тромбоцитов и эритроцитов в селезёнке, доказанной радиоизотопным методом, и при сохранности очагов нормального кроветворения в костном мозге.
Прогноз
Прогностически неблагоприятным признаком считают острое начало болезни. Формы с острым течением обычно устойчивы к терапии и через несколько недель заканчиваются смертью. Чаще течение болезни затяжное, многомесячное и даже многолетнее. Возможно длительное отсутствие клин, проявлений заболевания, однако у больных сохраняются признаки неполноценного костномозгового кроветворения.
Профилактика
Лица, профессионально связанные с воздействием миелотоксических факторов (источники ионизирующей радиации, бензольное производство), должны находиться под постоянным диспансерным наблюдением. Проведение цитостатического лечения по поводу опухолей и других заболеваний требует регулярного контроля состава крови и своевременного прекращения при угрозе гипоплазии кроветворения. Применение потенциально опасных препаратов, в первую очередь левомицетина, должно быть ограничено прямыми показаниями и находиться под контролем состава крови. Профилактика геморрагий при уже развившейся гипопластической анемии включает гормональное подавление менструального цикла у женщин с массивными меноррагиями, замену (по возможности) инъекционных лечебный препаратов пероральными, щажение слизистых оболочек (исключение грубой пищи, замена жёстких зубных щёток ватными тампонами). Для предотвращения инфекционных осложнений при глубокой гранулоцитопении рекомендуется подавление кишечной аутофлоры неабсорбируемыми антибиотиками, больных следует содержать в асептических или близких к ним условиях, следить за соблюдением личной гигиены.
Анемия Фанкони (синонимы: синдром Фанкони, врождённая панцитопения). Описана в 1927 год под названием «семейная детская пернициозоподобная анемия». С тех пор опубликовано около 200 наблюдений. Анемия, как правило, выявляется в первые годы жизни, изредка позже. Мальчики болеют в 2 раза чаще девочек. Характерно сочетание панцитопении и гипоплазии костного мозга с другими врождёнными дефектами — коричневой пигментацией кожи в связи с отложением меланина, атрофией почек и селезёнки, отсутствием или недоразвитием 1 пястной или лучевой костей, задержкой умственного, физического и полового развития, микроцефалией, микроофтальмией. При культивировании лимфоцитов и фибробластов кожи больных выявляются многочисленные хромосомные аберрации. У родственников больных часто отмечают лейкозы.
Лечение — назначают систематические переливания крови (эритроцитарной массы). Прогноз неблагоприятный.
Семейная гипопластическая анемия Эстрена — Дамешека впервые была описана в 1947 год. Ей свойственны те же изменения со стороны кроветворения, которые наблюдаются при анемии Фанкони, но аномалий развития скелета и внутренних органов не наблюдается.
Врождённая парциальная гипопластическая анемия Джозефса — Даймонда — Блекфена описана в 1936 год Джозефсом (W. Н. Josephs) и в 1938 год Даймондом и Блекфеном (L. К. Diamond, К. D. Blackfan). Генетический дефект, лежащий в основе болезни, не выяснен. Развитие болезни у нескольких детей, родившихся от разных матерей, но от одного отца, свидетельствует о доминантном характере наследования. Развёрнутая картина болезни обычно обнаруживается уже на 1-м году жизни: анемия различной степени сочетается с глубокой эритро- и нормобластопенией на фоне уменьшения количества миелокариоцитов (на начальных этапах развития болезни количество миелокариоцитов костного мозга может быть не изменено). У части больных выявляют другие врождённые дефекты (задержка полового и физических развития), но аномалии развития почек не встречаются. Вследствие многократных гемотрансфузий нередко развивается гемосидероз с портальным циррозом печени.
Лечение — систематические переливания крови (эритроцитарной массы) в сочетании с кортикостероидными гормонами и витамином В12. При помощи систематических гемотрансфузий удавалось довести больных детей до 8—15 лет, после чего наступало спонтанное улучшение.
Государственное образовательное учреждение высшего профессионального образования
КАЗАНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ
Федерального агентства по здравоохранению и социальному развитию
КАФЕДРА ГОСПИТАЛЬНОЙ ПЕДИАТРИИ С КУРСАМИ ПП И ПДО
Зав. кафедрой – д.м.н., профессор Булатов Владимир Петрович

Выполнила студентка группы 2607
Субханкулова Г.С.
Проверила преподаватель
Д.м.н., профессор Волгина С.Я.
КАЗАНЬ - 2013