Очистка конвертированного газа от CO2 – процесс, протекающий в несколько стадий. Во-первых, происходит физическая абсорбция газа (растворение), во-вторых – химическая реакция, результатом которой является связывание растворенного (абсорбированного) газа. Протекание абсорбционных процессов характеризуется их статикой и кинетикой:
Статика абсорбции, т. е. равновесие между жидкой и газовой фазами, определяет состояние, которое устанавливается при весьма продолжительном соприкосновении фаз. Равновесие между фазами определяется термодинамическими свойствами компонента и поглотителя и зависит от состава одной из фаз, температуры и давления.
Кинетика абсорбции, т. е. скорость процесса массообмена определяется движущей силой процесса (т. е. степенью отклонения системы от равновесного состояния), свойствами поглотителя, компонента и инертного газа, а также способом соприкосновения фаз (устройством абсорбционного аппарата и гидродинамическим режимом его работы). В абсорбционных аппаратах движущая сила, как правило, изменяется по их длине и зависит от характера взаимного движения фаз (противоток, прямоток, перекрестный ток и т. д.).
Различают физическую абсорбцию и хемосорбцию.
При физической абсорбции растворение газа не сопровождается химической реакцией (или, по крайней мере, эта реакция не оказывает заметного влияния на процесс). В данном случае над раствором существует более или менее значительное равновесное давление компонента и поглощение последнего происходит лишь до тех пор, пока его парциальное давление в газовой фазе выше равновесного давления над раствором. Полное извлечение компонента из газа при этом возможно только при противотоке и подаче в абсорбер чистого поглотителя, не содержащего компонента.
При хемосорбции (абсорбция, сопровождаемая химической реакцией) абсорбируемый компонент связывается в жидкой фазе в виде химического соединения. При необратимой реакции равновесное давление компонента над раствором ничтожно мало и возможно полное его поглощение. При обратимой реакции над раствором существует заметное давление компонента, хотя и меньшее, чем при физической абсорбции. Уравнение реакции, лежащей в основе хемосорбции рассматриваемого процесса при очистке конвертированного газа:
|
Бикарбонат калия взаимодействует с растворенным углекислым газом, связывая его, что влияет на изменение парциального давления над раствором. С помощью термодинамического анализа определим термодинамические условия протекания процесса, температуру, давление, концентрацию компонентов; определим тепловой эффект реакции и температуру начала реакции. Так же найдем условия протекания побочных реакций и условия максимального выхода целевого продукта (в случае очистки подразумеваем максимальное связывание примесей в ходе протекающей реакции).
4.1. ТЕРМОДИНАМИЧЕСКИЙ АНАЛИЗ
Воспользуемся энтропийным методом для расчета энергии Гиббса:

Термодинамические константы исходных веществ и продуктов реакции взяты из справочной литературы[3] и представлены в таблице 3.1.
Проводим расчет  и
и  по формулам:
по формулам:



 89,48 кДж/моль
89,48 кДж/моль
 89,48 кДж/моль
89,48 кДж/моль
Таблица 4.1.1
Термодинамические константы участников основной реакции
| Термодинамическая величина | Вещество | |||
| K2CO3 | H2O | CO2 | KHCO3 | |
 , кДж/моль , кДж/моль
| -1150,18 | -285,83 | -393,51 | -959,5 |
 , Дж/моль·К , Дж/моль·К
| 155,52 | 68,95 | 213,66 | 128,7 |
Реакция идет с небольшим выделением тепла (экзотермична), для смещения равновесия к продуктам необходимо отводить тепло от системы. За счет последующего применения отведенного тепла к другим процессам можем снизить затраты на энергию (вторичный энергоресурс).

 Дж/моль·K
Дж/моль·K
Процесс трудно осуществить при атмосферном давлении, так как энтропия отрицательна. Определим температуру начала реакции, используя следующее условие:
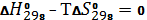

На основе температуры начала реакции выберем температурный интервал расчета энергии Гиббса: 300  600 К. С помощью энтропийного метода проведем расчет
600 К. С помощью энтропийного метода проведем расчет  при различных температурах:
при различных температурах:
 =
=  89480
89480  300· (
300· ( 182,13) =
182,13) =  34841 Дж/моль
34841 Дж/моль
 =
=  89480
89480  400· (
400· ( 182,13) =
182,13) =  16628 Дж/моль
16628 Дж/моль
 =
=  89480
89480  430· (
430· ( 182,13) =
182,13) =  11164 Дж/моль
11164 Дж/моль
 =
=  89480
89480  460· (
460· ( 182,13) =
182,13) =  5700,2 Дж/моль
5700,2 Дж/моль
 =
=  89480
89480  500· (
500· ( 182,13) = 1585 Дж/моль
182,13) = 1585 Дж/моль
 =
=  89480
89480  600· (
600· ( 182,13) = 19798 Дж/моль
182,13) = 19798 Дж/моль
Отобразим полученные данные на графике (рис. 4.1) в координатах  . Сделаем вывод о влиянии температуры на протекание реакции. Термодинамическая вероятность протекания основной реакции с увеличением температуры уменьшается, необходимость отведения тепла от системы подтверждается.
. Сделаем вывод о влиянии температуры на протекание реакции. Термодинамическая вероятность протекания основной реакции с увеличением температуры уменьшается, необходимость отведения тепла от системы подтверждается.

Рис. 4.1.1  График зависимости энергии Гиббса от температуры
График зависимости энергии Гиббса от температуры
Зависимость константы равновесия от температуры может быть представлена в виде уравнения:



Рассчитаем значения констант равновесия в указанном интервале температур, результаты представим в виде таблицы 4.2. Построим график зависимости константы равновесия от температуры протекания процесса.
Таблица 4.1.2
Значения константы равновесия основной реакции при различных температурах
| Температура, К | K2CO3 + H2O + CO2=2 KHCO3 | |
| lgKp | Kp | |
| 6,073 | 9,3 1013 | |
| 2,174 | 149,250 | |
| 1,358 | 22,790 | |
| 0,648 | 4,447 | |
| -0,166 | 0,683 | |
| -1,726 | 0,019 |

Рис. 4.1.2  График зависимости константы равновесия от температуры
График зависимости константы равновесия от температуры
Термодинамический анализ процесса очистки конвертированного газа от диоксида углерода раствором поташа позволил сделать следующие выводы:
1. В рассматриваемом интервале температур (300-600 К) термодинамическая вероятность самопроизвольного протекания процесса уменьшается, о чем свидетельствует значение энергии Гиббса.
2. Согласно принципу Ле-Шателье увеличение давления способствует смещению равновесия в сторону продуктов реакции (Растворимость СО2 в горячем растворе поташа в значительной степени зависит от парциального давления двуокиси углерода над раствором)
3. Увеличение концентрации раствора поташа по сравнению со стехиометрическим ведет к смещению равновесия в сторону продуктов реакции (предельная концентрация соли в горячем растворе 40%, т.к. дальше наблюдается выпадение осадка); горячие растворы поташа вызывают коррозионное разрушение углеродистой стали, поэтому в растворы добавляют ингибиторы коррозии.
4.2. КИНЕТИЧЕСКИЙ АНАЛИЗ
В качестве побочной реакции рассмотрим процесс, который применяют для выделения поглощенного газа (абсорбтива) из абсорбента и получения его в чистом виде, а также для повторного использования абсорбента в процессе абсорбции. Для проведения десорбции газа из жидкости необходимо, чтобы концентрация этого газа в газовой фазе была ниже концентрации, соответствующей равновесной в системе газ – жидкость. На практике для проведения процесса десорбции используют три следующих метода:
· отгонку в токе инертного газа или водяного пара;
· отгонку под действием подводимой к абсорбенту теплоты;
· отгонку при снижении давления над абсорбентом
Учитывая термодинамическую вероятность самопроизвольного протекания основной реакции, заключаем, что в интервале температур 300-600 К возможно протекание обратной реакции (десорбции газа), при подведением тепла к системе.
В общем случае метод хемосорбционной очистки обладает рядом особенностей оп сравнению с физической абсорбцией:
· Возможность абсорбции при низком парциальном давлении вследствие более высокой поглотительной абсорбции раствора;
· Относительно малая циркуляция раствора и соответственно небольшой расход энергии на перекачку сорбента;
· Регенерацию осуществляют, как правило, путем нагревания в сочетании со сбросом давления, при этом расход тепла на десорбцию относительно невелик;
· Регенерацию проводят часто при кипении абсорбента, его пары могут играть роль десорбирующего агента;
· Возможность проведения весьма тонкой очистки;
· Увеличение коррозии и протекание побочных реакций, обусловленных применением повышенных температур и щелочных агентом – сильных и слабых электролитов
Метод поташной очистки основан на применении относительно дешевого абсорбента, но имеет ряд недостатков: малая растворимость карбоната в воде (особенно бикарбоната) при обычной температуре, низкая скорость абсорбции, что приводит к необходимости значительной циркуляции раствора и обуславливает увеличение габаритов аппаратов. Кроме того, равновесное парциальное давление СО2 над растворами поташа относительно велико, и не удается достичь тонкой очистки газа (0,08 –0,15% СО2 в газе после очистки). Преимущество метода – сравнительно низкий расход тепла на регенерацию.
Скорость процесса абсорбции может быть рассмотрена через применение основного уравнения массопередачи[4]. Если выразить движущую силу процесса в концентрациях газовой фазы (парциальные давления), то оно принимает следующий вид:
Где – средняя движущая сила процесса, выраженная в единицах давления;
 – коэффициент массопередачи, отнесенный к единице движущей силы, выраженной через парциальные давления поглощаемого газа;
– коэффициент массопередачи, отнесенный к единице движущей силы, выраженной через парциальные давления поглощаемого газа;
Химическая реакция, сопровождающая процесс абсорбции, оказывает существенное влияние на кинетику процесса, т.к. скорость определяется не только интенсивностью массопереноса, но и скоростью протекания химической реакции. Благодаря химической реакции растворенный CO2 переходит в связанной состояние (KHCO3). Концентрация свободного газа в жидкости уменьшается, а процесс абсорбции ускоряется (рост величины), в сравнении с абсорбцией без химического взаимодействия фаз[1]. Скорость хемосорбция зависит как от скорости химической реакции, так и от скорости массопереноса между фазами. В зависимости от лимитирующего процесса различаются кинетическую и диффузионную области процесса хемосорбции.
Кинетическая область определяется как протекание процесса, при котором скорость химического взаимодействия меньше скорости массопереноса. В диффузионной области лимитирующая стадия – скорость диффузии компонента в зоне реакции, которая зависит от гидродинамических условий в системе и физических свойств.
Абсорбция, как и другие процессы, протекает на границе раздела фаз. Как следствие – абсорбционные аппараты (далее – абсорберы) должна иметь развитую поверхность контакта между жидкой и газовой фазами. Абсорберы по своим конструктивным особенностям делят на следующие основные группы: пленочные, насадочные, тарельчатые, распыливающие. На практике очистка конвертированного газа от CO2 проводится в насадочных колоннах. Варьирование площади поверхности раздела фаз происходит за счет смены насадки. Основные применяемые виды – кольца Рашига и седловидная насадка Берля.
Значения коэффициентов абсорбции CO2 растворами карбонатов могут быть вычисленные по уравнениям[4]:

Где  – объемный коэффициент абсорбции, отнесенный к газовой пленке, кмоль/(м3·ч·атм)
– объемный коэффициент абсорбции, отнесенный к газовой пленке, кмоль/(м3·ч·атм)
L – расход жидкости, кг/(м3·ч)
 – удельная поверхность несмоченной насадки, м2/м3
– удельная поверхность несмоченной насадки, м2/м3
C’, n – константы, зависящие от типа насадки

Где  – объемный коэффициент абсорбции, отнесенный к газовой пленке,
– объемный коэффициент абсорбции, отнесенный к газовой пленке,
кмоль/(м3·ч·атм)
 – удельная поверхность насадки, м2/м3
– удельная поверхность насадки, м2/м3
a – 0,288 + 0,00316u, (u – плотность орошения), м3/(м2  ч)
ч)
b = 0,0059
 – вязкость раствора
– вязкость раствора
Таблица 4.2
| Насадка | 
| n | 
|
| Кольца Рашига d=9,5 мм d=25 мм | 1,53 0,81 | 0,56 0,36 | |
| Седловидная (насадка Берля), l = 25 мм | 1,00 | 0,42 |
Выводы теоретического анализа:
1. По условиям равновесия абсорбция происходит тем полнее, чем ниже температура. Однако, скорость абсорбции тем выше, чем выше температура. На основании сопоставления термодинамических и кинетических факторов выбираем оптимальную температуру абсорбции 35-100оС. Реакции, протекающие при очистке, являются экзотермическими и обратимыми, при повышении температуры раствора химическое соединение разлагается с выделением исходных компонентов, регенерация раствора протекает при 120-135оС.
2. Согласно принципу Ле-Шателье увеличение давления способствует смещению равновесия в сторону продуктов реакции. На производстве применяется абсорбционный метод с давлением 2,5 – 2,8 мПа, с последующей тонкой очисткой растворами моноэтаноламина или едкого натра.
3. При десорбции применяется дросселирование поглотительного раствора, при котором раствор вскипает и CO2 выдувается образующимся водяным паром.
4. На основании справочных данных о влиянии степени карбонизации на температуру выпадения твердой фазы в водных растворах K2CO3, выбираем оптимальную концентрацию раствора 30 – 40%.
СИНТЕЗ И АНАЛИЗ ХТС
5.1. ХИМИЧЕСКАЯ МОДЕЛЬ
Абсорбционная очистка газа – циклический процесс, на стадии абсорбции диоксид углерода поглощается растворителем, очищенный газ отправляется на последующую переработку, а насыщенный раствор регенерируют, что требует дополнительного расхода энергии. Процесс абсорбции проводим в массообменном аппарате типа насадочной колонны (насадка – кольца Рашига или седловидная насадка Берля).
Первоначально происходит физическая абсорбция CO2 раствором, после чего поглощенный диоксид углерода вступает в реакцию с карбонатом калия. Благодаря химической реакции растворенный CO2 переходит в связанной состояние (KHCO3). Концентрация свободного газа в жидкости уменьшается, а процесс абсорбции ускоряется. Особую важность представляет десорбция компонента и вторичное использование поташного раствора в целях экономии сырья. При десорбции применяется дросселирование поглотительного раствора, при котором раствор вскипает и CO2 выдувается образующимся водяным паром.
Очистка газа поташным раствором основана на взаимодействии диоксида углерода с карбонатом калия по суммарному уравнению
K2CO3 + H2O + CO2 = 2 KHCO3
Скорость реакции практически полностью лимитируется скоростью медленно протекающей реакции в жидкой фазе
СO2 + ОН– = HCO3–
5.2. СТРУКТУРНАЯ СХЕМА

Схема 4.2.1 Структурная схема очистки конвертированного газа от СО2 раствором горячего поташа
Метод основан на применении относительно дешевого абсорбента, но имеет ряд недостатков: малая растворимость карбоната в воде (особенно бикарбоната), низкая скорость абсорбции, что приводит к необходимости значительной циркуляции раствора и обуславливает увеличение габаритов аппаратов. Кроме того, равновесное парциальное давление СО2 над растворами поташа достаточно велико, и не удается достичь тонкой очистки газа (0,08 – 0,15% СО2 в газ после очистки). Преимущество метода – сравнительно низкий расход тепла на регенерацию.
5.3. ТЕХНОЛОГИЧЕСКАЯ СХЕМА
Проведен анализ различных технологических схем, представленных в литературе[1] [4] [5] [8] [9]. Выделены следующие виды схем: с разделенным потоком, схема поташной очистки с активатором, схема поташной очистки без активатора.
Описание технологической схемы
Газ под давлением 12,5 – 15 атм при температуре 155оС, которая развивается при сжатии его в компрессоре, поступает в теплообменник 1, куда подводится отработанный раствор после абсорбции. Часть тепла газ передает раствору, охлаждаясь при этом до температуры 125-130 оС, затем проходит водяной холодильник 2, где охлаждается до 122оС, и через влагоотделитель 3 поступает в абсорбер 4.
В абсорбере имеется несколько слоев насадки из колец Палля. Сюда подается регенерированный раствор поташа, 2/3 которого из регенератора 5 поступает в нижнюю часть абсорбера при температуре 102 °С. Примерно 1/3 раствора охлаждается в водяном холодильнике до 80 °С и затем подается в верхнюю часть абсорбера. Такая схема циркуляции раствора способствует снижению остаточного содержания СО2 в газе.
В абсорбере 4 газ очищается с 18 – 19% начальной концентрации СО2 до остаточного содержания 0,3 – 1,5% и при температуре 80 °С выходит из абсорбера. Далее очищенный газ охлаждается в водяных холодильниках и, пройдя влагоотделитель, поступает на сжатие в газовые компрессоры.
Отработанный поташный раствор удаляется из абсорбера через автоматический клапан регулятора уровня, проходит теплообменник 1 и дросселируется в верхнюю часть регенератора 5, где поддерживается избыточное давление порядка 0,06 – 0,07 атм. При этом из раствора выделяется двуокись углерода, концентрация которой достигает 99,5 – 99,8% СО2.
Регенератор представляет собой вертикальный колонный аппарат с двумя слоями насадки из колец Палля. Раствор стекает сверху вниз по насадке; при нагревании его парам из раствора выделяется двуокись углерода. К низу регенератора подключен выносной подогреватель, в котором раствор нагревается глухим паром до 104 – 105 °С.
Горячий регенерированный раствор перекачивается из регенератора насосом 8 на орошение абсорбера 4. Уровень раствора в регенераторе регулируется изменением подачи свежего конденсата в куб этого аппарата.
Операторная и технологическая схема поташной очистки конвертированного газа от СО2 приведены в приложениях 1 и 2 соответсвенно.



