Налейте в три пробирки примерно на 1/4 объёма раствор хлорида натрия. Затем добавьте во вторую пробирку немного раствора серной кислоты, в третью – немного раствора гидроксида натрия. Во все пробирки добавьте по 2 капли раствора K3[Fe(CN)6]. Перемешайте содержимое и аккуратно опустите в каждую пробирку по гвоздю, предварительно очищенному наждачной бумагой. Отметьте наблюдаемые изменения содержимого в пробирках. Заполните таблицу. О скорости коррозии железа можно судить по окраске раствора (чем больше ионов Fe2+ образуется в результате окисления железа, тем большей интенсивности будет синяя окраска раствора). Сравнительную скорость коррозии обозначьте цифрами от 1 до 3 (наименьшая скорость – 1, наибольшая – 3).
| № | Ионы, находящиеся в растворе | рН раствора | Окраска раствора | Сравнительная скорость коррозии |
| Na+, Cl–, Н2О, О2 | ||||
| Н+, SO42–, Н2О, О2 | ||||
| Na+, ОН–, Н2О, О2 |
Составьте уравнения реакций на анодных и катодных участках при электрохимической коррозии железа, протекающей в каждой пробирке. После опыта гвозди промойте и сложите в фарфоровую чашку.
Раствор 1
анод Fe ____ – __ 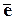
 _____
_____
катод Fe3C ____ + ____ + __ 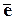
 _____
_____
Раствор 2
анод Fe ____ – __ 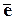
 _____
_____
катод Fe3C ________ + __ 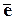
 _____
_____
Раствор 3
анод Fe ____ – __ 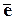
 _____
_____
катод Fe3C ____ + ____ + __ 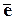
 _____
_____
Вывод. _________________________________________________________________
________________________________________________________________________
Ответьте на дополнительные вопросы к этой работе.
Опишите процессы при электрохимической коррозии окрашенного, оцинкованного и лужёного железа (белая жесть) при нарушении целостности защитных покрытий в кислотной агрессивной среде (рН<7)
Окрашенное железо:
 анод (___): ____ – __
анод (___): ____ – __ 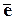 = ____
= ____
катод (___): ____ + __ 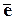 = ____
= ____
Белая жесть (лужёное железо):
 анод (___): ____ – __
анод (___): ____ – __ 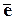 = ____
= ____
катод (___): ____ + __ 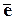 = ____
= ____
Оцинкованное железо:
 анод (___): ____ – __
анод (___): ____ – __ 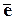 = ____
= ____
катод (___): ____ + __ 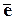 = ____
= ____
Сравните коррозионную стойкость образцов.
_____ _______________________________________________________________
________________________________________________________________________
Названия распространённых кислот и кислотных остатков
| Кислота | Название кислоты | Кислотный остаток | Название кислотного остатка |
| НAlO2 | Метаалюминиевая | (AlO2)– | Метаалюминат |
| Н3АlO3 | Ортоалюминиевая | (АlO3)3– | Ортоалюминат |
| Н3ВО3 | Ортоборная (борная) | (ВО3)3– | Ортоборат |
| Н2В4О7 | Четырёхборная | (В4О7)2– | Тетраборат |
| НСООН | Муравьиная | (НСОО)– | Формиат |
| СН3СООН | Уксусная | (СН3СОО)– | Ацетат |
| HCN | Циановодородная | (CN)– | Цианид |
| Н2СО3 | Угольная | (СО3)2– | Карбонат |
| Н2С2О4 | Щавелевая | (С2О4)2– | Оксалат |
| HF | Фтороводородная (плавиковая) | F– | Фторид |
| НС1 | Хлороводородная (соляная) | С1– | Хлорид |
| НВг | Бромоводородная | Вг– | Бромид |
| HI | Йодоводородная | I– | Иодид |
| НС1О | Хлорноватистая | (С1О)– | Гипохлорит |
| НClO2 | Хлористая | (ClO2)– | Хлорит |
| НClO3 | Хлорноватая | (ClO3)– | Хлорат |
| НС1O4 | Хлорная | (С1O4)– | Перхлорат |
| НCгО2 | Метахромистая | (CгО2)– | Метахромит |
| H2CrO4 | Хромовая | (CrO4)2– | Хромат |
| H2Cr2O7 | Двухромовая | (Cr2O7)2– | Дихромат |
| НMnO4 | Марганцовая | (MnO4)– | Перманганат |
| Н2МnО4 | Mарганцовистая | (МnО4)2– | Манганат |
| НNО2 | Азотистая | (NО2)– | Нитрит |
| НNО3 | Азотная | (NО3)– | Нитрат |
| НРО3 | Метафосфорная | (РО3)– | Метафосфат |
| Н3РO4 | Ортофосфорная (фосфорная) | (РO4)3– | Ортофосфат (фосфат) |
| Н2S | Сероводородная | S2– | Сульфид |
| НSCN | Родановодородная | (SCN)– | Роданид |
| Н2SO3 | Сернистая | (SO3)2– | Сульфит |
| Н2SO4 | Серная | (SO4)2– | Сульфат |
| Н2S2О3 | Тиосерная | (S2О3)2– | Тиосульфат |
| Н2SiO3 | Кремниевая | (SiO3)2– | Силикат |

 2016 г.
2016 г.