Введение.
Все клетки организма, а их около 200 типов, происходят из единственной клетки – зиготы. Для развития эмбриона требуется значительное увеличение клеточной массы, а затем дифференцировка в различные клеточные типы, которые сформируют определенные ткани и органы организма. Такое под силу только внутренней клеточной массе (ВКМ) предимплантационной бластоцисты. Если культивировать эти клетки in vitro в присутствии подавляющих дифференцировку сигналов, то можно получить клеточные линии, называемые эмбриональными стволовыми клетками (ЭСК). Линии ЭСК могут быть также получены из одного бластомера 8-клеточного эмбриона и подвергнуты диффренцировке в различные клеточные типы под воздействием определенных факторов. ЭСК характеризуются способностью возобновлять себя и дифференцироваться в различные типы клеток (плюрипотентность).
Все клетки организма имеют идентичный геном, хотя очень сильно различаются морфологически и функционально. Эти различия являются результатом экспрессии или инактивации различных генов посредством эпигенетических изменений, которые могут репрограммировать работу генома в процессе развития организма.
Эпигенетические механизмы регуляции экспрессии генов можно определить как наследственный код, отличный от геномной последовательности нуклеотидов, который включает пост-трансляционную модификацию гистонов, ДНК-метилирование цитозина в CpG-динуклеотидах, АТФ-зависимый ремоделлинг хроматина, обмен гистонов и их вариантов и различные типы малых РНК, которые участвуют в инактивации и экспрессии генов. На самом деле, имеет смысл выделить три краеугольных эпигенетических механизма регуляции экспрессии генов: метилирование ДНК, модификацию гистонов и РНК-интерференцию (Рис. 1). Указанные эпигенетические механизмы вовлечены в регуляцию экспрессии и инактивации генов на уровне транскрипции посредством плотности упаковки ДНК и гистонов в хроматин. Экспрессия генов тесно связана с состоянием хроматина. Для активного хроматина (эухроматина) характерно «рыхлое» расположение нуклеосом на ДНК, наличие факторов ремоделирования хроматина, более свободный доступ к ДНК для эндонуклеаз, репликация локуса ДНК в начале S-фазы, пространственное перемещение (выпетливание) хроматина в районах конститутивного гетерохроматина. Неактивный хроматин (гетерохроматин) обладает противоположными характеристиками.

Рис. 1. Три основных эпигенетических механизма регуляции экспрессии генов: метилирование ДНК, модификация гистонов, РНК-интерференция.
Эпигенетические метки, такие как метилирование ДНК и модификации гистонов, могут быть скопированы в S-фазе и, следовательно, эпигенетическая информация может быть передана через ряд последовательных клеточных делений. Эта особенность «эпигенетического наследования» привела к тому, что состоянию хроматина стали отводить центральную роль в поддержании транскрипционных характеристик генома в процессах развития, в том числе, и в поддержании плюрипотентности стволовых клеток (СК). Однако не следует забывать, что эпигенетическая регуляция является крайне сложным комплексным процессом, когда все три основные составляющие работают во взаимодействии. Так, метилирование ДНК может вызвать деацетилирование и метилирование/деметилирование гистоновых белков, метилирование/деметилирование гистонов может привести к метилированию ДНК, малые РНК в составе сложных белковых комплексов могут вызывать метилирование ДНК, модификации гистонов, а так же напрямую инактивировать тот или иной ген в процессах развития посредством РНК-интерференции (блокирование трансляции или деградация мРНК). Поэтому имеет смысл коротко рассмотреть три основных варианта эпигенетической регуляции, как таковых, а затем в процессах раннего эмбрионального развития и в ЭСК.
Основные эпигенетические механизмы, регулирующие экспрессию генов.
Метилирование/деметилирование ДНК в эмбриональных стволовых клетках.
Эпигенетические изменения, основанные на метилировании ДНК, и последующая инактивация определенных генов требуются для того, чтобы запустить процессы дифференцировки. Это было показано при исследовании ЭСК, дефектных либо по метилтрансферазам Dnmt1, Dnmt 3a и Dnmt3b, либо по белку CGBP, который связывается с неметилированной ДНК в районах CpG-островков (Табл 1). В таких клетках было выявлено гипометилирование ДНК и полная невозможность дифференцировки. Первоначально, почти все метилированные цитозины в ДНК, унаследованные от материнской и отцовской гамет, деметилируются в оплодотворенной яйцеклетке (Рис. 5).
Затем происходит восстановление метилирования во время имплантации эмбриона. Однако, CpG-островки, которые контролируют экспрессию генов,
Табл. 1. Фенотипические проявления мутаций ДНК-метилтрансфераз и метилсвязывающих белков.
| Модификатор | Функция | Мутантный фенотип у мышей |
| Метилирование ДНК | ||
| DNMT1 | ДНК метилтрансфераза | Деметилирование генома, остановка развития на Е8,5 |
| DNMT3a | ДНК метилтрансфераза | Патология кишечника, аномалии сперматогенеза, постнатальная летальность в 4 недели |
| DNMT3b | ДНК метилтрансфераза | Деметилирование микросателлитной ДНК, дефекты нервной трубки, эмбриолетальность на сроке Е14,5-Е18,5 |
| Метилсвязывающие белки | ||
| Mbd3 | Ремоделирующий хроматин комплекс NuRD | Нормальная имплантация, остановка развития на сроке Е6,5 |

Рис. 5. Динамика деметилирования на ранних стадиях эмбриогенеза.
остаются неметилированными на этой стадии, а метилирование de novo и инактивация генов происходит после имплантации. Этот механизм отвечает за инактивацию гена Oct4 и генов на инактивированной Х-хромосоме женских эмбрионов в постимплантационную стадию.
Было показано, что количество генов, активно экспрессирующихся в недифференцированных ЭСК, намного превышает количество таковых в тканях взрослого организма. Когда ЭСК начинают дифференцироваться в определенный клеточный тип, большое количество генов, поддерживавших плюрипотентность, выключается, а начинают работать гены, чья экспрессия характерна для определенной ткани. Это связано с тем, что значительное число CpG-островков в ЭСК поддерживается в неметилированном состоянии и доступно для транскрипции. Эмбриональные клетки in vitro с пособны быстро деметилировать трансфецированную ДНК, CpG-островки которой полностью метилированы, это подтверждает способность ЭСК поддерживать регуляторные районы многих генов в неметилированном состоянии, тем самым осуществляя их экспрессию. Практически моментальная потеря связывания хроматин-ассоциированных белков в ЭСК также способствует транскрипционной доступности и плюрипотентности этих клеток.
Табл. 2. Фенотипические проявления мутаций белков, осуществляющих модификации гистонов и ремоделлинг хроматина.
| Модификатор | Функция | Мутантный фенотип у мышей |
| Модификация гистонов | ||
| Ehmt1 | Гистоновая метилтрансфераза | Отставание в развитии, летальность на сроке Е9,5, снижение Н3К9me1 и Н3К9me2 в эмбрионах. |
| Ehmt2 | Гистоновая метилтрансфераза | Потеря метилирования Н3К4 в эухроматине, остановка роста и развития на сроке Е8,5 |
| Eset | Гистоновая метилтрансфераза | Пери-имплантационная летальность (Е3,5-Е5,5) |
| Suv39h | Гистоновая метилтрансфераза | Потеря метилирования Н3К9 в гетерохроматине, нарушение спаривания хромосом во время сперматогенеза, летальность на сроке Е14,5 |
| Ezh2 | Гистоновая метилтрансфераза | Патология роста примитивной эктодермы, пери-имплантационная летальность |
| MII | Гистоновая метилтрансфераза | Аномалии скелета, потеря метилирования Н3К4me1, аномальное метилирование ДНК, морфогенетические аномалии, эмбриональная летальность |
| PRMT1 | Аргининовая метилтрансфераза | Постимплантационная летальность до гаструляции |
| Gcn5 | Гистоновая ацетилтрансфераза | Летальность на сроке Е7,5-Е8,5 |
| HDAC1 | Гистоновая деацетилтрансфераза | Дефекты пролиферации, отставание в развитии, эмбриолетальность на сроке Е10,5 |
| PcG-репрессоры | ||
| Eed | PRC2/3 комплекс | Патология гаструляции, отсутствие инактивации Х-хромосомы в клетках трофобласта |
| Suz12 | PRC2/3 комплекс | Ранняя пост-имплантационная летальность, патология гаструляции |
| YY1 | PRC2/3 комплекс | Патология роста эпибластных клеток, пери-имплантационная летальность |
| Rnf2 | Убиквитин-лигаза PRC1 комплекса | Патология гаструляции, летальность на сроке Е9,5 |
| Ремоделлинг хроматина | ||
| Brg1 | SWI/SNF комплекс | Патология роста примитивной эктодермы и трофэктодермы, пери-имплантационная летальность |
| Snf5 | SWI/SNF комплекс | Пери-имплантационная летальность |
| Lsh | SWI/SNF комплекс | Глобальное деметилирование геномной ДНК на стадии Е13,5, постнатальная летальность |
| Srg3 | SWI/SNF комплекс | Летальность на стадии имплантации, аномалии роста ВКМ |
| ATRX | SWI/SNF комплекс | Эмбриолетальность самцов на сроке Е9,5 в следствие патологии формирования экстраэмбрионального трофобласта и инактивации Х-хромосомы |
1.2.3. Эпигенетические м одификации гистонов в ЭСК.
Было установлено, что хроматин менее плотно упакован, а значит транскрипционно активен в недифференцированных ЭСК, по сравнению с дифференцированными клетками. Дифференцировка ЭСК приводит к более плотной упаковке перицентромерного гетерохроматина в результате деацетилирования гистона H4 в этих районах. В дифференцированных клетках многие инактивированные гены располагаются вблизи центромерного гетерохроматина, хотя в ЭСК такой пространственной компартментализации инактивированных генов не наблюдается.
Время репликации также является важной характеристикой состояния хроматина. Первоначально считалось, что репликация в начале S-фазы свидетельствует о транскрипционной активности генов. В последнее время показано, что время репликации зависит от состояния хроматина, а не от транскрипции и достаточно хорошо коррелирует с ацетилированием гистонов. Было показано, что значительное количество генов, кодирующих факторы транскрипции и не экспрессирующихся в ЭСК, потому что они необходимы для более поздних стадий развития, все-таки реплицируются в начале S-фазы.
1.2.3.1.Бивалентное состояние хроматина и PcG репрессоры.
Описание свойств хроматина ЭСК необходимо для понимания молекулярных характеристик, свойственных плюрипотентному статусу. Исследования хроматина на глобальном уровне, в определенных локусах и в конкретных районах локализации генов, регулирующих процессы развития показали, что многие нетранскрибирующиеся гены в ЭСК имеют хроматиновые метки, которые обычно ассоциированы с активно транскрибирующимися генами, представленные высоким уровнем ацетилирования гистонов H3 и H4, а так же ди- и триметилированием лизина 4 гистона H3. Удивительно, но промоторы этих генов обогащены и репрессирующей транскрипцию меткой, представленной триметилированием лизина 27 гистона H3 (Рис. 10). Практически получается, что активирующие и инактивирующие транскрипцию эпигенетические метки хроматина присутствуют в одно и тоже время в одном и том же месте.
Такая необычная «бивалентная» структура хроматина преимущественно возникает в промоторных районах высоко консервативных генов в ЭСК, включая семейства транскрипционных факторов Sox, Fox, Pax, Irx и Pou. Уникальный паттерн модификации гистонов в ЭСК поддерживает их плюрипотентность и инактивацию тканеспецифических генов за счет доминирующего эффекта метилирования Н3К27 по сравнению с метилированием Н3К4. Таким образом, гены, которые контролируют

Рис. 10. В ЭСК хроматиновые метки, которые обычно ассоциированы с активно транскрибирующимися генами имеют высокий уровень ацетилирования гистонов H3 и H4, а так же ди- и триметилирование H3К4. Промоторы этих генов обогащены и репрессирующей транскрипцию меткой, представленной триметилированием H3К9 и Н3К27.
процессы дифференцировки в ЭСК, расположены в относительно «доступной» конформации хроматина, которая поддерживается за счет баланса метилирования Н3К27 и Н3К4. Метилирования Н3К9 в районах хроматина, содержащих «бивалентную» метку, как правило, не обнаруживается, т.к. оно более характерно для структурного гетерохроматина. Когда ЭСК начинают дифференцироваться, репрессирующая модификация гистона Н3 снимается и экспрессия генов запускается. Необходимо отметить, что ряд генов, которые осуществляют начальные этапы дифференцировки ЭСК, не имеют бивалентной хроматиновой метки, хотя располагаются в районах доступного хроматина и временно инактивированы. Вполне вероятно, что они регулируются пока еще не охарактеризованным эпигенетическим механизмом. В дифференцированных и прогениторных клетках триметилирование H3K27 присутствует в промоторных районах многих нетранскрибирующихся генов, но меток активного хроматина уже не обнаруживается. Это новая модель регуляции генов в плюрипотентных клетках, где многие тканеспецифические регуляторные гены эпигенетически помечены для последующей экспрессии, но в ЭСК находятся в состоянии «низкого старта» (Рис. 11).
Метилирование H3K27 катализируется белковым комплексом, относящимся к семейству PcG белков. PcG репрессоры были охарактеризованы как мультибелковые комплексы, необходимые для инактивации ряда генов, в том числе Hox - семейства, в развивающемся эмбрионе. Имеющиеся данные свидетельствуют о том, что эти белки выполняют важную роль в ЭСК.
Мишенями PcG являются регуляторы транскрипции, которые инактивированы в плюрипотентных клетках, но начинают экспрессироваться при дифференцировке клеток. Многие из этих генов имеют бивалентное состояние хроматина в ЭСК. В эксперименте показано, что в ЭСК, в которых
отсутствуют белки PcG, начинают экспрессироваться тканеспецифические гены.
Существует, по крайней мере, четыре различных PcG комплекса, два из которых необходимы для нормального функционирования ЭСК – PRC (Polycomb repressor complexes) 1 и 2. Метилирование Н3К27 катализируется PRC2, в состав которого входят белки EED, SUZ12, EZH12. Метилированный Н3К27 создает сайт связывания для PRC1, который содержит белки RING1A, RING1B и BMI1. В ЭСК, где RING1B не функционирует, начинают экспрессироваться транскрипционные факторы, такие как Msx1, HoxA7, Gata4,
которые так же начинают экспрессироваться в случае отсутствия EED. Таким образом, оба PRC комплекса участвуют совместно в подавлении транскрипции.
Возможно, существует и другой путь регуляции транскрипции в ЭСК. Показано, что PRC комплексы могут пространственно сближать определенные геномные локусы, расположенные далеко друг от друга, даже на разных
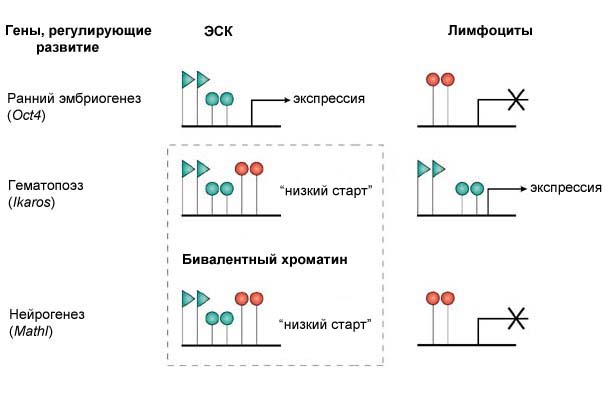
Рис. 11. Бивалентная метка хроматина тканеспецифичных генов, инактивированных в ЭСК.
хромосомах. Это приводит к включению механизмов репрессии транскрипции, основанных на формировании более высокой по организации структуры хроматина. Но, скорее всего, эти белки локально влияют на инициацию транскрипции и ремоделирование нуклеосом. Связывание PcG белков, вероятно, нарушает собственно топологию ДНК, что приводит к формированию негативных суперспиральных витков. Кроме того, эти белки обладают РНК-связывающими свойствами, а это может приводить к РНК-зависимому формированию гетерохроматина. Согласно такой возможности, один из ключевых компонентов РНК интерференции - белок Argonaute 1, обнаружен совместно с PcG комплесами в промоторных районах инактивированных генов.
Один из ключевых PcG белков - EZH2, имеет свойство привлекать ДНК-метилтрансферазы к определенным мишеням. В ЭСК такая роль указанного белка может являться важным компонентом в непростой взаимосвязи между плюрипотентностью и канцерогенезом. Районы метилирования Н3К27 в опухолевых клетках, но не при нормальном развитии, подвергаются метилированию ДНК de novo. Поскольку метилирование ДНК может стабилизировать инактивацию гена, то почему не предположить, что в ЭСК такой механизм осуществляет инактивацию генов, ответственных за пролиферацию и дифференцировку. В результате популяция СК становится нечувствительной к сигналам дифференцировки, что приводит к постоянному самовозобновлению клеток и, возможно, формированию опухоли.
1.3.2.Микро РНК и РНК интерференция в эмбриональных стволовых клетках.
Постранскрипционная регуляция экспрессии генов в ЭСК может осуществляться с помощью механизма РНК интерференции. То, что miРНК играют роль в дифференцировке ЭСК, было установлено в результате обнаружения miРНК, специфических для ЭСК. При сравнении библиотек miРНК, полученных из мышиных ЭСК и дифференцированных клеток было выявлено значительное количество таких РНК, характерных для ЭСК. Шесть miРНК (miR-290, miR291-as, miR292-as, miR-293, miR-294, miR-295),
происходящие из одной шпилечной структуры, экспрессировались в недифференцированных ЭСК или начавших дифференцироваться, но только до 4 дня, а затем их экспрессия в эмбриоидных тельцах не выявлялась. По-видимому, эти miРНК специфичны именно для плюрипотентных ЭСК. В ЭСК человека выявлено около 50 miРНК. Одной из характерных черт является кластеризация miРНК. Один кластер, содержащий 8 miРНК и занимающий около 700 п.н., локализован на хромосоме 4, другой – протяженностью 1050 п.н., картирован на хромосоме 19 и содержит 4 miРНК. Кластерированные miРНК транскрибируются одним полицистронным фрагментом, а затем процессируются в самостоятельные miРНК. Экспрессионный уровень первичных транскриптов этих двух кластеров резко снижается, когда ЭСК начинают дифференцироваться. В то же время, в эмбриоидных тельцах начинает экспрессироваться другой набор miРНК. Пока остается непонятным, как эти miРНК участвуют в поддержании недифференцированного состояния ЭСК.
То, что miРНК играют ключевую роль в поддержании недифференцированного состояния, а затем участвуют в процессе дифференцировки ЭСК, показано на мышах с инактивированным геном эндонуклеазы Dicer (Табл. 3). Эмбрионам характерна ранняя летальность и потеря стволовых клеток, а так же резко сниженная пролиферация и нарушенный клеточный цикл с увеличением доли клеток в фазах G1 и G0 и снижением - в фазах G2 и M. Это косвенно подтверждает, что miРНК необходимы для нормального функционирования ЭСК и нормального процесса развития эмбриона. ЭСК, в которых отсутствует Dicer, не дифференцируются, а формируют клеточные агрегаты. Таким образом, отсутствие Dicer и эндогенных miРНК полностью нарушают потенциал дифференцировки ЭСК.
miРНК активно участвуют и в дальнейшем эмбриональном развитии. В процессе формирования конечностей участвуют miРНК lin-41, let-7 и miR-196; в адипогенезе принимает участие miR-143; в миогенезе – miR-1-1, miR-1-2 и miR-181; в гематопоэзе – miR-181, miR-142s и miR-223; в нейрогенезе – miR-9, miR-142a, miR-124b, miR-135, miR-153, miR-183, miR-219, miR-125a, miR-125b, miR-128, miR-132, miR-137 и miR-139.

Рис. 13. Метилирование промоторных районов генов посредством siРНК.
Табл. 3. Фенотипические проявления мутаций белков, осуществляющих процессинг miРНК.
| Модификатор | Функция | Мутантный фенотип у мышей |
| Метаболизм miРНК | ||
| Ago2 | Процессинг miРНК | Летальность на сроке Е9,5 |
| Dicer | Процессинг miРНК | Постимплантационная летальность до гаструляции |
В настоящее время продолжается поиск и характеристика новых miРНК, участвующих в регуляции экспрессии генов как в ЭСК, так и на ранних этапах эмбрионального развития, выяснение их функций и мишеней.
Другой важной областью применения РНК-интерференции в ЭСК является поиск новых генов, необходимых для поддержания плюрипотентности и самовозобновления стволовых клеток, и участвующих в регуляции начальных этапов дифференцировки, а так же для выяснения функциональных возможностей этих генов. Если во взрослом организме, как в норме, так и при патологии, регуляторные каскады в большей или меньшей степени определены, то генные регуляторные сети ранних этапов эмбриогенеза практически не изучены. Это тем более важно, т.к. гены, выполняющие определенную функцию во взрослом организме, могут регулировать и быть регулируемы совсем иным спектром генов. Механизм РНК-интерференции позволяет выяснить функции и взаимосвязи новых и известных генов, участвующих в начальных стадиях эмбриогенеза, за счет временной инактивации (т.н. нокдаун) этих генов. Большинство уже выявленных генов (Oct4, Nanog, Foxd3, Sox2 и др.), регулирующих недифференцированное состояние ЭСК, были обнаружены в результате анализа профиля экспрессии в эмбрионах на ранних этапах развития. Новая технология, посредством miРНК, siРНК и нокдауна генов позволяет интенсифицировать процесс поиска новых генов и сделать его менее затратным.
С помощью РНК-интерференции уже начаты исследования по дифференцировке ЭСК. В частности, нокдаун транскрипционного фактора PU.1 определяет дифференцировку в про-В клетки. Нокдаун ключевого гена Oct4 приводит к дифференцировке в клетки трофэктодермы. В ответ на временную инактивацию Oct4 начинается экспрессия генов Fgfr1, PI-1, Cdx2 и Hand1, характерных для трофэктодермы. Временная инактивация гена транскрипционного фактора Smad4, который, совместно с BMP4, определяет дифференцировку в клетки мезодермы, приводит к гиперэкспрессии гена Pax6 (ген аниридии), что характерно для нейроэктодермальных клеток. Эти эксперименты показывают, что временная инактивация ключевых регуляторных генов может быть использована для определения путей дифференцировки.
РНК-интерференция в ЭСК позволяет лучше понять взаимодействие генов в глобальных путях регуляции. Транскрипционные факторы Sox2, Oct4 и Nanog необходимы для поддержания плюрипотентности ЭСК. Ранее было показано кооперативное взаимодействие Sox2 и Oct4 в управлении экспрессией ряда генов, необходимых для поддержания плюрипотентного фенотипа. В результате нокдауна указанных генов в ЭСК промотор Nanog теряет свою активность в регуляции маркерного гена GFP, что свидетельствует о регуляторной взаимосвязи между Sox2, Oct4 и Nanog. Высокие дозы ретиноевой кислоты (10-5–10-6 М) индуцируют дифференцировку ЭСК в нейрональные клетки, тогда как низкие дозы (10-8–10-9 М) индуцируют дифференцировку в мышечные клетки, включая скелетные мышцы и кардиомиоциты. Оказалось, что ген-супрессор опухолевого роста p53 участвует в этом процессе. Если его инактивировать с помощью РНК-интерференции, ЭСК будут дифференцироваться только в мышечные клетки, даже при высоких дозах ретиноевой кислоты. Нокдаун p53 не оказывает эффекта на экспрессию плюрипотентных генов, таких как Oct4 и кислой фосфатазы, что наглядно показывает, что это самостоятельный путь дифференцировки, а доза гена является критичной во время эмбриогенеза.