Основным критерием химического взаимодействия атомов, ионов и молекул является изменение электронной плотности.
Образовавшаяся новая молекула устойчива только в том случае, если энергия возникших частиц ниже энергии исходных, т. е. имеет место выделение энергии и уменьшение энтальпии системы.
Полностью заполненные (согласно принципу Паули) двумя электронами атомные орбитали являются стабильными. По этой причине и атомы, имеющие такие орбитали, являются устойчивыми и не проявляют химической активности (например, инертные газы). Поскольку любая система (в том числе и атомная) стремится занять устойчивое положение, то атомы в химических реакциях стремятся приобрести завершенные электронные оболочки.
При образовании более сложных систем происходит перераспределение валентных электронов между атомами, участвующими в образовании химической связи. В зависимости от характера распределения электронной плотности в веществе различают три основных типа химической связи: ковалентную, ионную и металлическую.
 |
Соединения высшего порядка, содержащие комплексный ион как в кристалле, так и в растворе, называются комплексными соединениями. Причиной комплексообразования может быть как электростатическое, так и донорно-акцепторное взаимодействие, осуществляемое между ионами, между ионами и молекулами, между молекулами.
В качестве комплексообразователей чаще всего выступают атомы и ионы d- и f -элементов, что объясняется наличием у них свободных (n -2) f -, (n -1) d -, ns - и np -орбиталей.
Комплексообразователь – центральный атом или ион координационного соединения, вокруг которого скоординированы все остальные частицы этого соединения.
Лиганды (адденды) – ионы, атомы или молекулы, которые непосредственно связаны с комплексообразователем.
Координационное число комплексообразователя – число лигандов (монодентантных, то есть занимающих одно место), окружающих центральный атом или ион.
Внутренняя координационная сфера – комплекс, образованный лигандами с комплексообразователем.
Внешняя координационная сфера – ионы, нейтрализующие заряд комплексного иона.
На рис.4 представлена схема комплексной молекулы тетрайодидмеркурата натрия Na2[HgI4] с указанием ее составляющих.
Для объяснения образования и свойств комплексных соединений в настоящее время применяются метод валентных связей (МВС), теория кристаллического поля (ТКП) и метод молекулярных орбиталей (ММО).
|
|
|
|
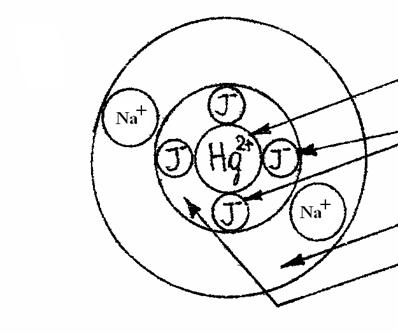
Рис. 4. Схема комплексной молекулы
Согласно МВС образование комплексного соединения осуществляется за счет донорно-акцепторного взаимодействия чаще всего неподеленных электронных пар лигандов и свободных орбиталей комплексообразователя. Так, образование октаэдрического иона [Cr(H2O)6]3+ можно объяснить следующим образом. Ион Cr3+, имеющий свободные 3 d -, 4 s -, 4 p -орбитали, выступает в качестве акцептора шести электронных пар, представляемых молекулами воды:


 4 р
4 р
 Сr3+ (d 3)
Сr3+ (d 3)
4 s








d 2 sp 3 – гибридизация



 H2O OH2 3+
H2O OH2 3+
│/
 Cr3+ + 6: OH2 H2O ―Cr―OH2
Cr3+ + 6: OH2 H2O ―Cr―OH2
акцептор донор / │
H2O OH2
 |  |
Октаэдрическое строение иона [Cr(H2O)6]3+ обусловлено d 2 sp 3 – гибридизацией валентных орбиталей хрома.
Комплексные соединения в растворах проявляют свойства сильных электролитов и полностью диссоциируют на внутреннюю координационную сферу (комплексный ион) и внешнюю координационную сферу (обычный ион).
Комплексные частицы (внутренняя сфера – ионы, молекулы) являются слабыми электролитами, поэтому их электролитическая диссоциация – обратимый процесс, количественно характеризуемый константой нестойкости комплекса (Кн) (табл. 2.2).
[Cr(H2O)6]Cl3 → [Cr(H2O)6]3+ + 3Cl  ; (2.1)
; (2.1)
[Cr(H2O)6]3+  [Cr(H2O)5]3++H2O;
[Cr(H2O)5]3++H2O;  ; (2.2)
; (2.2)
[Cr(H2O)5]3+  [Cr(H2O)4]3++H2O;
[Cr(H2O)4]3++H2O;  ; (2.3)
; (2.3)
[Cr(H2O)4]3+  [Cr(H2O)3]3++H2O;
[Cr(H2O)3]3++H2O;  ; (2.4)
; (2.4)
…………………………………………………………………………….
[Cr(H2O)]3+  Cr3++H2O;
Cr3++H2O;  . (2.5)
. (2.5)
Т а б л и ц а 2.2
Диссоциация комплексных частиц. Константы нестойкости
| Уравнение диссоциации | Кн |
[Ag(NH3)2]+  Ag+ + 2NH3 Ag+ + 2NH3
| 9,3·103 |
[AgI3]2-  Ag+ + 3I Ag+ + 3I 
| 2,6·107 |
[Ag(CN)2]   Ag+ + 2CN Ag+ + 2CN 
| 8,0·10-22 |
[Co(NH3)6]2+  Co2+ + 6NH3 Co2+ + 6NH3
| 7,7·10-6 |
[Co(NH3)6]3+  Co3+ + 6NH3 Co3+ + 6NH3
| 3,1·10-33 |
[Co(SCN)4]2-  Co2+ + 4SCN Co2+ + 4SCN 
| 1,0·10-3 |
[Cu(NH3)4]2+  Cu2+ + 4NH3 Cu2+ + 4NH3
| 2,1·10-13 |
[Fe(CN)6]3-  Fe3+ + 6CN Fe3+ + 6CN 
| 1,0·10-44 |
[Fe(CN)6]4-  Fe2+ + 6CN Fe2+ + 6CN 
| 1,0·10-37 |
Реакции комплексообразования обычно сопровождаются визуальными эффектами: появлением или изменением окраски, выпадением или растворением осадков.
Эти эффекты используются в аналитической химии для открытия различных катионов, для перевода малорастворимых соединений в хорошо растворимые комплексы, для разделения катионов, для маскировки ионов. Свойства комплексных соединений используются также в технологиях производства, очистки и обработки металлов, сплавов.
ОТВЕТИТЬ НА КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Какими физическими явлениями подтверждается двойст-венная природа электрона?
2. Объясните, чем обусловлено различное количество элементов в 1-, 2-, 3-, 4-м периодах?
3. Раскройте физический смысл главного, орбитального, магнит-ного, спинового квантовых чисел.
4. Укажите, как информация о квантовых числах отражается в таблице Д.И. Менделеева.
5. Объясните расположение s -, p -, d -, f -элементов в таблице Д. И. Менделеева, укажите их валентные электроны.
6. Для валентных электронов атома с конфигурацией 1 s 22 s 22 p 63 s 23 p 4 напишите значения квантовых чисел.
7. Объясните, почему в семействе лантаноидов и актиноидов по 14 элементов?
8. Объясните, как изменяются потенциал ионизации, электроотрицательность, радиус атома, восстановительная способность в ряду элементов (указать период или группу):
| Последняя цифра номера зачётки | |||||
| Ряд элементов | 3Li-10Ne | 19 19K-36Kr | 5 55 Cs-85At | 12 12Mg-17Cl | 38 38Sr-52Te |
| Последняя цифра номера зачётки | |||||
| Ряд элементов | 8O-84Po | 6C-82Pb | 9F-85At | 22Ti-72Hf | 7N-83Bi |
9. Что такое ковалентная связь? Покажите образование ковалентной связи на примерах молекул F2, HCl, CH4. Какова обычная электронная структура ковалентно связанных атомов?
10. Напишите электронную структуру соединений водорода с элементами пятой, шестой и седьмой групп: NH3, H2O, HF. Как распределяются электроны ковалентной связи между двумя связанными атомами при определении электронной структуры каждого атома?
11. Какие атомные орбитали участвуют при образовании гибридных орбиталей в молекуле СН4? Чему равны углы между этими гибридными орбиталями?
12. Приведите примеры молекул, при образовании которых имеет место sp -, sp 2-, sp 3 – гибридизация атомных орбиталей. Какова пространственная структура этих молекул?
13. Покажите образование химических связей в молекулах: H2O, Cl2, HF и определите, в каком случае ковалентная связь является наиболее полярной? Что служит количественной мерой полярности ковалентной связи?
14. Существует ли резкая граница между соединениями с ковалентными и ионными связями?
15. Исходя из электронного строения частиц, определите, какие из них при образовании ковалентной связи могут проявлять роль акцепторов и какие – роль доноров:
1) Н+ ; 2) Al3+ ; 3) O2- ; 4) F- ; 5) Ti4+ ; 6) B3-.
16. Для комплексного соединения Na3[Cr(OH)6] укажите:
1) комплексообразователь; 2) лиганды; 3) координационное число комплексообразователя.
Напишите уравнение электролитической диссоциации этого комплексного соединения в водном растворе и выражение константы нестойкости комплексного иона.
17. На основании электронного строения частиц Zn2+, NH3 укажите, какая из них является донором электронов при образовании комплексного соединения [Zn(NH3)4]SO4.
18. На основании электронного строения частиц Pt4+, Cl- определите, какая из них является акцептором электронов при образовании комплексного соединения K2[PtCl6].
19. Определите степень окисления и координационное число комплексообразователя в следующих соединениях: K4[PtCl6NH3], [PtCl2(NH3)2].