Углеводы
Углеводы (или старое название сахарá) — полигидроксикарбонильные соединения и их производные природного происхождения.
1) моносахариды,
2) олигосахариды,
3) полисахариды.
1. моносахариды
Моносахариды (или монозы) ¾ это полигидроксикарбонильные соединения и их производные с непрерывной углеродной цепью.
Молекулы моносахаридов хиральны, содержат несколько асимметрических атомов углерода.
В зависимости от характера карбонильной группы:
1) альдозы
2) кетозы
Например:
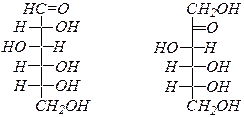
альдоза кетоза
В зависимости от количества атомов углерода в молекуле (от 3 до 10) моносахариды подразделяют на триозы, тетрозы, пентозы, гексозы, гептозы и т. д. Например:

тетроза пентоза гексоза
Изомерия, номенклатура
Структурная и оптическая виды изомерии.
В молекуле единственной альдотриозы, глицеринового альдегида, имеется один хиральный атом углерода, поэтому возможны только два энантиомера.

D- глицериновый альдегид, L- глицериновый альдегид
Альдотетрозы:
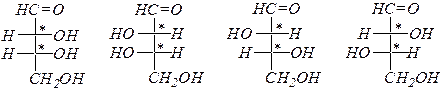
D- эритроза L- эритроза D- треоза L- треоза
Относительная конфигурация каждого из моносахаридов определяется по конфигурационному стандарту – глицериновому альдегиду. Отнесение к D- или L- ряду определяется по конфигурации наиболее удалённого от карбонильной группы хирального атома углерода. Каждой альдозе D- ряда соответствует энантиомер (вещество L- ряда) с противоположной конфигурацией всех центров хиральности.
Альдопентозы:
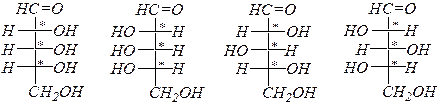
D- рибоза L- рибоза D- ксилоза L- ксилоза
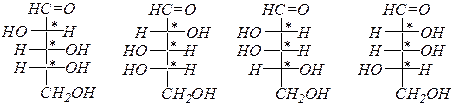
D- арабиноза L- арабиноза D- ликсоза L- ликсоза,
Альдогексозы:
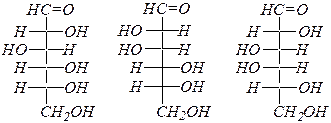
D- глюкоза D- манноза D- галактоза
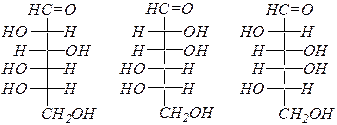
L- глюкоза L- манноза L- галактоза
Из кетоз наиболее широко распространены фруктоза и сорбоза:

D- фруктоза L- фруктоза D- сорбоза L- сорбоза
Диастереомеры, различающиеся конфигурацией только одного асимметрического атома углерода, называются эпимерами. Эпимеры ¾ частный случай диастереомеров.
Образование циклических полуацеталей.
Например, для D- рибозы:

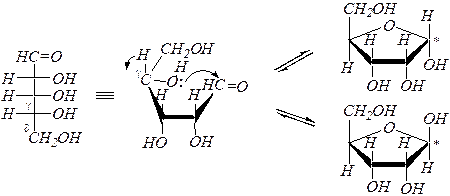
Полуацетальную гидроксильную группу в химии углеводов называют также гликозидной.
Для изображения циклических форм моносахаридов приняты перспективные (пространственные) формулы, предложенные У. Хеуорсом* в 1926 г. (как показано в схеме).
При построении формул Хеуорса цикл условно считают плоским, при этом ближняя к наблюдателю часть кольца обычно выделяется более жирной линией. Кислородный атом цикла располагают на наибольшем удалении от наблюдателя. Атомы и группы атомов, изображаемые в формулах Фишера слева и справа, в формулах Хеуорса располагаются соответственно над и под плоскостью цикла. Боковые цепи, содержащие не попавшие в цикл атомы углерода в альдозах изображают над плоскостью для D- изомеров и под плоскостью для L -изомеров (при атомах С4 в альдопентозах и С5 в альдогексозах).
Образование циклического полуацеталя ¾ это пример цикло-оксотаутомерии или кольчато-цепной таутомерии.
Возможно существование пиранозных (шестичленных) и фуранозных (пятичленных) циклических форм.
Аномеры (a-аномер и b-аномер) представляют собой частный случай эпимеров. Принадлежность к a- или b-форме определяется конфигурацией аномерного атома углерода (для альдоз – это С1, для кетоз – это, как правило, С2). В молекуле a-аномера относительные конфигурации аномерного атома углерода и последнего асимметрического атома в углеродной цепи совпадают. В молекуле b-аномера, наоборот, не совпадают.
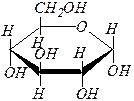 a-аномер
a-аномер
| 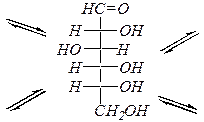
| 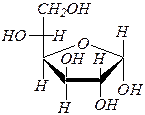 a-аномер
a-аномер
|
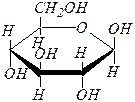 b-аномер
b-аномер
|
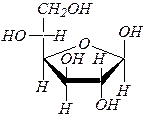 b-аномер
b-аномер
|
Полное название моносахарида включает обозначение конфигурации аномерного атома углерода (a- или b-) и размера цикла (пиранозный или фуранозный). Например:
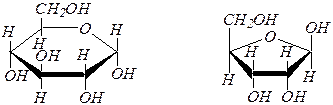
a ,D- глюкопираноза b, D- рибофураноза
Для кетоз образование циклических форм происходит аналогично альдозам.
В твёрдом состоянии все моносахариды находятся преимущественно в пиранозной форме, как самой устойчивой из возможных циклических форм. Разные аномеры (a- и b-) D- глюкозы различаются величиной удельного вращения: у a-аномера ¾ +112°, у b-аномера ¾ +19°.
В растворах образуется равновесная смесь всех циклических форм и оксоформы. Для водных растворов D- глюкозы этот угол +52,5°. Это происходит вследствие аномеризации, т.е. взаимопревращения a- и b-аномеров друг в друга через промежуточную оксоформу, и установления таутомерного равновесия.
Связанное с этим явлением изменение угла вращения плоскости поляризованного света называется мутаротацией.
Химические свойства
Моносахариды могут
1) вступать в реакции с участием оксогруппы,
2) проявляют свойства полуацеталей,
3) свойства многоатомных спиртов (например, дают качественную реакцию на многоатомные спирты – взаимодействие с Cu(OH)2 с образованием устойчивых комплексов).
Реакции открыто-цепных форм
Реакции AN.Примеры:
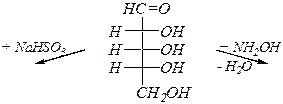 D- рибоза D- рибоза
| ||
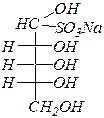 бисульфитное производное D- рибозы
бисульфитное производное D- рибозы
| 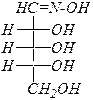 оксим D- рибозы
оксим D- рибозы
|
Аналогично с фенилгидразином:

Однако с избытком фенилгидразина реакция протекает дальше и образуются озазоны:

| 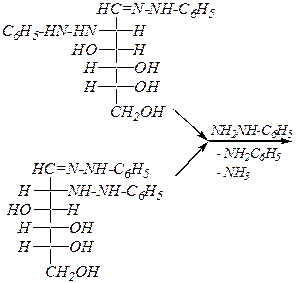
|
| фенилгидразон D -маннозы | |
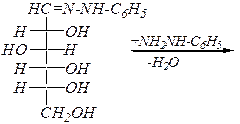 фенилгидразон D -глюкозы
фенилгидразон D -глюкозы
|
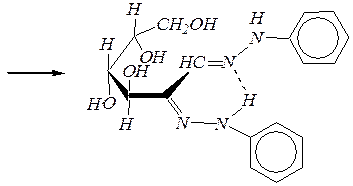
При нагревании со щёлочью происходит изомеризация альдоз в кетозы (и обратно) и в эпимерные альдозы через енольную форму. Например:
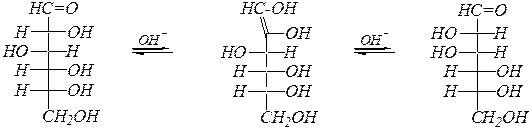
| ||
| D -глюкоза | 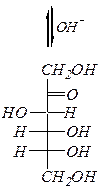 D -фруктоза
D -фруктоза
| D -манноза |
Реакции восстановления оксогруппы также возможны только в оксоформе, и они приводят к соответствующим многоатомным спиртам. Восстановление проводят водородом на металлических катализаторах. При этом из кетоз образуется смесь эпимерных спиртов. Например:
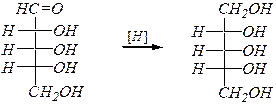
D -рибоза D -рибит
Альдозы легко подвергаются окислению по свободной альдегидной группе.
Под действием мягких окислителей образуются альдоновые кислоты, которые обычно существуют в виде d- или g-лактонов:

D -глюконовая кислота и её d-лактон
Окислители: бромная вода, реактив Толленса (реакция серебряного зеркала), свежеосаждённый гидроксид меди (II) (или гидроксид меди в виде реактива Фелинга). Окисление альдоз до альдоновых кислот протекает обычно в кислой или нейтральной среде.
При использовании разбавленной азотной кислоты образуются «аровые» (гликаровые) кислоты, в молекулах которых окислены оба концевых атома углерода. Например:
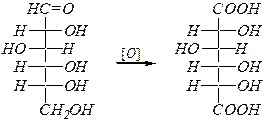
D -глюкаровая кислота
А при окислении только первичноспиртовой группы могут быть получены альдегидокарбоновые кислоты, так называемые уроновые кислоты. Но такое окисление обычно возможно только для циклических форм моносахаридов – см далее.
Окисление в щелочной среде сопровождается изомеризацией альдоз в кетозы и обратно, а также эпимеризацией, например, глюкозы в маннозу и обратно. Поэтому в этих условиях могут окисляться и кетозы, предварительно изомеризуясь, образуя альдоновые кислоты.
Реакции циклических форм
Полуацетальная гидроксильная группа легко реагирует, например, со спиртами в условиях кислотного катализа с образованием полных ацеталей, называемых также в химии углеводов гликозидами.
Название продукта: суффикс с окончанием - оза заменяется суффиксом - озид.
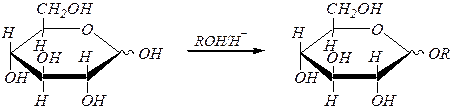
a(b), D- глюкопираноза алкил-a(b), D- глюкопиранозид
Несахарный фрагмент гликозида называют агликоном.
О- гликозиды и N- гликозиды.
Для получения О -алкилгликозидов обычно используют спирты, насыщенные сухим хлороводородом – механизм реакции SN 1:
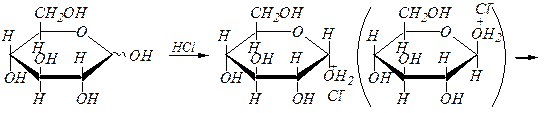
a(b), D- глюкопираноза
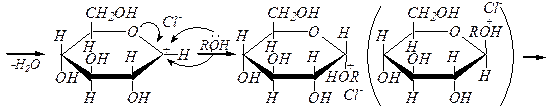
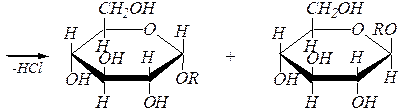
алкил-a, D- глюкопиранозид алкил-b, D- глюкопиранозид
Образующиеся гликозиды, являясь полными ацеталями, гидролизуются в кислой среде, но устойчивыпри действии разбавленных щелочей:
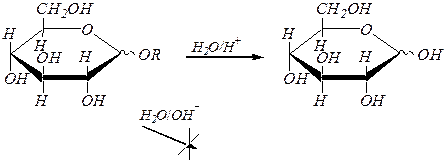
При обработке щелочными растворами диметилсульфата (CH3)2SO4 или йодалканов образуются простые эфиры с участием всех спиртовых гидроксогрупп:
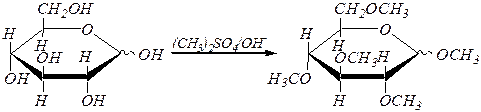
a(b), D- глюкопираноза метил-2,3,4,6-тетра- О -метил-a, D- глюкопиранозид
и метил-2,3,4,6-тетра- О -метил-b, D- глюкопиранозид
Образующиеся простые эфиры гидролизу не подвергаются, а гликозидная группа легко гидролизуется в кислой среде:
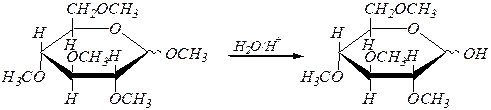
2,3,4,6-тетра- О -метил-a, D- глюкопираноза
и 2,3,4,6-тетра- О -метил-b, D- глюкопираноза
Реакции ацилирования моносахаридов протекают с участием ангидридов или галогенангидридов карбоновых кислот. При этом также образуется смесь a- и b-аномеров. Образующиеся сложные эфиры полностью гидролизуются как в кислой, так и в щелочной среде:

a(b), D- галактопираноза ацетил-2,3,4,6-тетра- О -ацетил-a(b), D- галактопиранозид
или a(b), D- галактопираноза пентаацетат
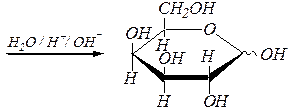
a, D- галактопираноза и b, D- галактопираноза
Окисление первичноспиртовой группы (без участия альдегидной группы альдоз), протекающее в фиксированных циклических формах, т.е. для гликозидов моносахаридов, приводит к образованию уроновых кислот. Например:
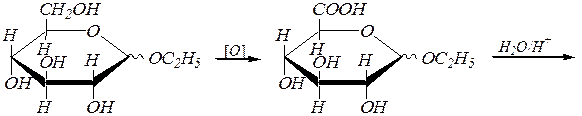
этил-a(b), D- глюкопиранозид
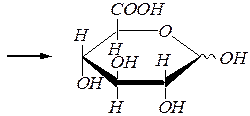
a(b), D- глюкуроновая кислота
Реакции дегидратации
При нагревании моносахаридов с минеральными кислотами может происходить внутримолекулярная дегидратация. Для ксилозы – образование фурфурола(фуран-2-карбальдегид):
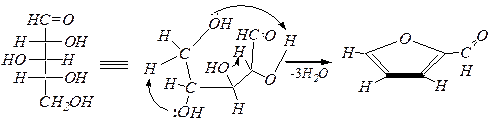
D- ксилоза фурфурол
Реакции удлинения и укорочения углеродной цепи — переходы триоза ® тетроза ® пентоза ® гексоза ® гептоза и обратно.
Углеродная цепь наращивается циангидринным методом:
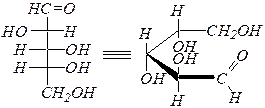
| 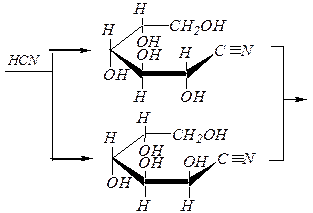
|
| D -арабиноза | |
| нитрилы D- глюконовой и D- манноновой кислот |
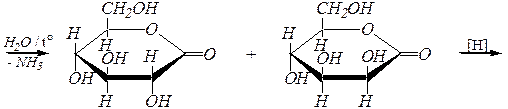
лактоны D- глюконовой и D- манноновой кислот

D- глюкоза D- манноза
Укорочение углеродной цепи альдоз — по методу Руффа:
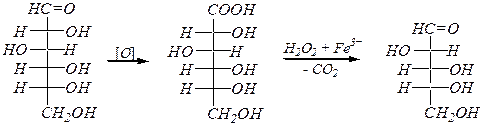
D- глюкоза D- глюконовая кислота D- арабиноза
2. олигосахариды
Олигосахариды ¾ это углеводы, молекулы которых состоят из нескольких (от 2 до 10) моносахаридных остатков, соединённых гликозидными связями.
Дисахариды (биозы), трисахариды, тетрасахариды и т.д.
классификация и номенклатура дисахаридов
Восстанавливающими дисахариды.
Невосстанавливающими дисахариды.
А) восстанавливающие
| 1) | 
|
| мальтоза ¾ 4- О -(a, D -глюкопиранозил)-a(b), D -глюкопираноза | |
| 2) | 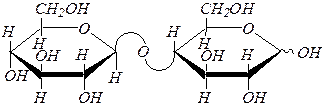
|
| целлобиоза ¾ 4- О -(b, D -глюкопиранозил)-a(b), D -глюкопираноза | |
| 3) | 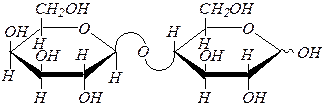
|
| лактоза ¾ 4- О -(b, D -галактопиранозил)-a(b), D -глюкопираноза |
Б) невосстанавливающие
| 1) | 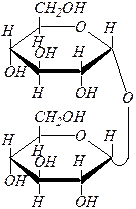
| трегалоза ¾ a, D -глюкопиранозил-a, D -глюкопиранозид |
| 2) | 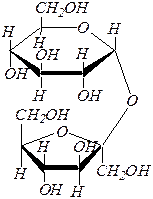
| сахароза ¾ a, D -глюкопиранозил-b, D -фруктофуранозид, или b, D -фруктофуранозил-a, D -глюкопиранозид |