При увеличении заряда ядра атома последовательное заполнение электронных орбиталей происходит от орбиталей с меньшим значением суммы главного и побочного квантовых чисел к орбиталям с большим значением этой суммы.
Второе правило Клечковского.
При одинаковых значениях суммы главного и побочного квантовых чисел заполнение орбиталей происходит в направлении возрастания значений главного квантового числа.
| подуровень | 1s | 2s | 2p | 3s | 3p | 3d |
| n + l | ||||||
| подуровень | 4s | 4p | 4d | 4f | 5s | 5p |
| n + l |
Исходя из данной таблицы, можно расположить подуровни в порядке их заполнения: 1s-2s-2p-3s-3p-4s-3d-4p-5s-4d-5p-4f и так далее.
Приведем пример заполнения электронами электронной оболочек нескольких атомов:
атом калия: 1s22s22p63s23p63d04s1
атом натрия: 1s22s22p63s1
атом серы: 1s22s22p63s23p4
атом ртути: 1s22s22p63s23p63d104s24p64d104f145s25p65d105f06s2
Из правил Клечковского есть отклонения, поскольку не все атомы подчиняются им. В некоторых случаях атому энергетически более выгодно заполнить подуровень электронами наполовину (только с положительными спинами) или полностью. Например, d-подуровень заполняется пятью электронами, а не четырьмя, как это может произойти, если руководствоваться при заполнении правилами Клечковского.
Например, у атома хрома по правилам Клечковского электронная конфигурация внешнего подуровня имеет вид 3d44s2, однако в реальности она имеет вид 3d54s1.
Такое явление получило название «проскок электрона». В данной таблице приведены некоторые химические элементы с электронной конфигурацией внешнего подуровня, у которых наблюдается «проскок электрона».
| Химический элемент | Конфигурация внешнего подуровня |
| Медь | 3d104s1 |
| Серебро | 4d105s1 |
| Золото | 5d106s1 |
| молибден | 4d55s1 |
Если требуется заполнить электронами энергетический уровень какого-либо катиона или аниона, то необходимо определить число электронов. Для катионов оно будет уменьшаться на величину заряда, а для анионов наоборот увеличиваться на туже величину.
Например, для сульфид - аниона S2- число электронов будет равно 18, а для катиона железа(+III) Fe3+ - 23.
ХИМИЧЕСКАЯ СВЯЗЬ
 Химическая связь – взаимодействие атомов или частиц, обусловливающее устойчивость молекулы или кристалла как целого.
Химическая связь – взаимодействие атомов или частиц, обусловливающее устойчивость молекулы или кристалла как целого.

Металлическая связь - химическая связь между атомами в металлическом кристалле, возникающая за счёт обобществления их валентных электронов.
Ковалентная связь – химическая связь, образующаяся за счет обобществления пары валентных электронных облаков. Ковалентная связь в свою очередь подразделяется на полярную (химическую связь между элементами с разными значениями электроотрицательностей) и неполярную (химическую связь между элементами с одинаковыми значениями электроотрицательностей).
 |
(H2O, HCl, H2S, CH4, C2H2) (H2, O2, O3, N2, Cl2, F2)
Если ковалентная связь образуется между водородом и сильно электроотрицательным элементом с не поделенной парой электронов (F, O, N), то такая связь называется водородной. Водородная связь может быть внутримолекулярной, а также межмолекулярной.
Соединения, в которых реализуются только ковалентные связи, имеют молекулярное строение. Например, в серной кислоте между всеми атомами реализуются лишь ковалентные связи, поэтому данное соединение имеет молекулярное строение, т.е. является молекулой.
Ковалентная связь также может быть простой и сложной. Простые ковалентные связи представляют собой σ-связи, а сложные связи (кратные) состоят из σ и π -связей.
σ-связь – ковалентная связь, образованная между двумя атомами вдоль линии, соединяющей ядра этих атомов.
π-связь – ковалентная связь, образованная между двумя атомами перпендикулярно линии, соединяющей ядра этих атомов.
σ -связи присутствуют во всех молекулах органических и неорганических веществ, в то время как π -связи присутствуют только в молекулах, в которых имеются кратные связи, например, в этилене, ацетилене, кислороде и т.д.
|
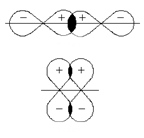
Способы образования ковалентной связи
1.Обменный.
Каждый атом отдает по одному неспаренному электрону в общую электронную пару.
H· + ·H → H:H
2.Донорно-акцепторный.
Один атом предоставляет не поделённую пару электронов, а второй – свободную (вакантную) орбиталь. Атом с парой электронов называется донором, а атом с свободной орбиталью – акцептором.
H3N: + □H+ → NH4+
донор акцептор
Способы разрыва ковалентной связи:
1.Гомолитический (радикальный).
В результате разрыва связи образуются свободные радикалы (частицы с одним неспаренным электроном).
Сl:Cl → Cl· + Cl·
радикалы
2.Гетеролитический (ионный).
В результате разрыва связи образуется частица с свободной орбиталью, заряженная положительно (катион) и частица с не поделенной парой электронов, заряженная отрицательно (анион).
H:Cl → □H+ +:Cl-
катион анион
Гибридизация орбиталей
Гибридизацией орбиталей называют процесс смешения орбиталей одного атома, имеющих близкие энергии.
В результате гибридизации образуются орбитали – гибриды, которые имеют форму несимметричной восьмерки, вытянутой в одну сторону. Такие орбитали имеют одинаковую форму и энергию. Сколько орбиталей участвует в процессе гибридизации, столько же и в итоге получится гибридных орбиталей.
Название гибридизации и тип полученных орбиталей определяется типом орбиталей (s, p, d), участвующих в процессе гибридизации.
Рассмотрим образование sp, sp2 и sp3 гибридизованных орбиталей.
1. sp гибридизация
В данном виде гибридизации участвуют одна s и одна p-орбитали. Две гибридных sp- орбитали в результате взаимного отталкивания располагаются относительно атомного ядра таким образом, что угол между ними составляет 180°. В результате такого расположения орбиталей молекулы имеют линейное строение.
2. sp2 гибридизация
В данном виде гибридизации участвуют одна s и две p-орбитали. Три гибридные орбитали располагаются в одной плоскости под углом 120˚ друг к другу. В результате такого расположения орбиталей вещества имеют форму плоского треугольника.
3. sp3 гибридизация
В данном виде гибридизации участвуют одна s и три p-орбитали. Четыре гибридные орбитали располагаются под углом 109˚28̍ друг к другу и направлены к вершинам тетраэдра, в центре которого находится атомное ядро. В результате такого расположения орбиталей молекулы имеют тетраэдрическое строение.
В органической химии в молекулах, имеющих тройные связи, присутствует sp гибридизация, в молекулах, имеющих двойные связи – sp2 гибридизация, а в молекулах, имеющих только одинарные связи – sp3 гибридизация.
Ионная связь – связь, реализующаяся между атомами с большими значениями электроотрицательностей за счет сил электростатического притяжения. Ионная связь присутствует в соединениях ионного строения, например, в солях и основаниях.
Обратите внимание, что в солях аммония между азотом и водородом образуется ковалентная связь, а между катионом аммония и анионом – ионная.
 |
Аморфные вещества – вещества, которые не имеют кристаллической структуры в своем строении. Такие вещества изотропны, то есть они не обнаруживают различных свойств в разных направлениях и не имеют определенной точки плавления. Клеи, смолы, стекла, пластилин – примеры веществ, являющихся аморфными.
Кристаллические вещества - твердые вещества, в которых присутствует упорядоченное расположение атомов, образуя так называемую кристаллическую решетку.
Кристаллическая решетка – некий геометрический образ, служащий для описания строения веществ, имеющих кристаллическое строение
 | |||||
 |  |
Молекулярная кристаллическая решетка обусловлена ковалентными связями внутри химического вещества. Такая молекулярная решетка присутствует в строении молекул, имеющих ковалентные связи (двухатомные простые вещества – неметаллы, молекулы неорганических и органических соединений).
Атомная кристаллическая решетка наблюдается в атомах – неметаллах, например в углероде (алмазе и графите), а также в диоксиде кремния и оксиде алюминия.
Ионная кристаллическая решетка имеется в соединениях, с ионным строением (оксиды, гидроксиды типичных металлов, солях), а металлическая кристаллическая решетка наблюдается в металлах и их сплавах.
Химическая связь характеризуется длиной, энергией, полярностью и поляризуемостью.
Длина связи – расстояние между двумя ядрами атомов, образующих химическую связь. Длину связи принято измерять в нанометрах (нм) или ангстремах (Аᵒ).
| Химическая связь | С-С | С=С | С≡С | С(sp3)-H |
| Длина связи (нм) | 0,154 | 0,134 | 0,120 | 0,110 |
Анализируя табличные данные, приходит к выводу, что простые связи (одинарные) самые длинные, более короткие – двойные и самые короткие – тройные.
Чтобы разорвать ту или иную химическую связь необходимо затратить некоторую энергию.
Энергия связи – энергия, которую необходимо затратить на разрыв данной химической связи с образованием отдельных газообразных атомов. Единицы измерения энергии связи Дж/моль или кал/моль.
В следующей таблице представлены значения энергий для некоторых химических связей.
| Химическая связь | С-С | С=С | С≡С | С(sp3)-Н |
| Энергия связи (кдж/моль) |
Исходя из табличных данных, можно сделать вывод: самая прочная связь является тройная, менее прочная – двойная и самая непрочная – одинарная. Энергия связей зависит от их кратности.
Следует также отметить, что чем больше радиус атомов, образующих химическую связь, тем меньше значение энергии этой связи. Эта закономерность выражается, например, в ряду галогеноводородов.
 | |||
 | |||
H-Cl H-Br
Полярность – параметр химической связи, который определяется различной электроотрицательностью атомов, образующих связь. Единицей измерения полярности служит Дебай (D).
| Химическая cвязь | H-C(sp3) | H-N | H-О | H-F |
| Полярность (D) | 1,1 | 1,4 | 1,5 | 1,9 |
Наиболее полярной является связь, образованная атомами с большой разностью электроотрицательностей.
Поляризуемость – способность смещаться электронной плотности связи под действием внешнего электрического поля или другого воздействия