16.
Кинетика – раздел физической химии, изучающий скорости и механизмы химических реакций.
Скорость химической реакции – это число элементарных актов реакции в единицу времени
в единицу объема (для гомогенных систем) или на единицу поверхности раздела фаз (для гетерогенных систем)
По механизму химические реакции делят на простые и сложные. К простым относятся реакции, которые протекают только в одну стадию. Например, разложение галогенов: I2= 2I. Если же реакция протекает в несколько стадий, то она является сложной. Например, реакция разложения пероксида водорода записывается суммарным уравнением:
2Н2О2= 2Н2О + О2
Однако эта реакция протекает в две стадии и является сложной:
1) Н2О2= Н2О + О
2) О + О = О2.
Сложные реакции в свою очередь делят на последовательные, параллельные и сопряженные. Последовательные - реакции с промежуточными стадиями типа А → В → С. Параллельные - исходные вещества реагируют сразу в нескольких направлениях: 
Например, 
Сопряженные - реакции, из которых одна протекает лишь совместно с другой. Например, Н2О2легко окисляет соединения железа, но практически не окисляет бензол. Однако если провести эти реакции в общей смеси, то Н2О2в этом случае окисляет и бензол:
Fe2+ + H2O2 = Fe3+ + OH- OH- + OH- + C6H6 = C6H5OH + H2O.
По числу фаз химические реакции делят на гомогенные - протекают в одной фазе и гетерогенные - протекают в разных фазах
Химическая кинетика изучает механизм протекания процесса, т.е. те промежуточные стадии, состоящие из элементарных актов, через которые система переходит из начального состояния в конечное.
Химическая кинетика изучает скорости этих стадий и факторы, влияющие на их скорость.
Уравнение химической реакции показывает начальное состояние системы (исходные вещества) и её конечное состояние (продукты реакции), но не отражает механизма процесса. Однако путь перехода системы из начального в конечное состояние может быть достаточно сложным и «извилистым».
Изучить кинетику реакции – значит показать, как реально протекает исследуемая реакция, её механизм, получить зависимость, связывающую скорость реакции с факторами, влияющими на неё.
· Простые реакции осуществляются посредством однотипных элементарных актов. Под элементарным актом понимают единичный акт взаимодействия или превращения частиц, в результате которого образуются новые частицы продуктов реакции или промежуточных соединений.
Пример: 𝐵𝑎2++𝑆𝑂42−=BaSO4
Для осуществления сложных реакций необходимы разнотипные (не менее двух) элементарные акты.
Различают следующие типы сложных реакций: параллельные, последовательные, сопряженные, цепные. Для параллельных реакций характерно протекание нескольких процессов с участием одних и тех же исходных веществ. Эти процессы завершаются образованием разных продуктов реакции.
Последовательными называются сложные реакции, протекающие таким образом, что вещества, образующиеся в результате одной стадии (т.е. продукты этой стадии), являются исходными веществами для другой стадии.
Сопряжёнными принято называть сложные реакции, протекающие следующим образом: одна из реакций может протекать самостоятельно, а вторая возможна только при наличии первой. Вещество А, общее для обеих реакций, носит название актор, вещество В – индуктор, вещество D, взаимодействующее с А только при наличии первой реакции – акцептор.
AДФ+ H3PO4 = ATФ+ H2O
АТФ+ субстрат
Цепными называют реакции, состоящие из ряда взаимосвязанных стадий, когда частицы, образующиеся в результате каждой стадии, генерируют последующие стадии. Как правило, цепные реакции протекают с участием свободных радикалов.
H2 + Cl2 "2HCl
свет
Cl ¸ Cl " Ċl + Ċl (радикалы)
Ċl + H2"HCl +H•
H• + Cl2 " HCl + Ċl и т.д.
Гомогенные реакции – реакции, протекающие полностью в одной фазе.
N2(г) + O2(г) = 2NO2(г)
Гетерогенные реакции – химические реакции с участием веществ, находящихся в разных фазах или на границе раздела фаз.
Fe(тв) +CuSO4(р) = CuSO4(тв) +FeSO4(р)
17.
Скорость химической реакции – число элементарных актов реакции в единицу времени в единицу объёма(для гомогенных систем) или на единицу поверхности раздела фаз(для гетерогенных систем).
Средняя скорость реакции: Vср= ±𝐶2−𝐶1𝑡2−𝑡1 [моль/л*сек] Если концентрация увеличивается, то +, если уменьшается, то –.

В химической кинетике различают среднюю и истинную (или мгновенную) скорость реакции. Средняя скорость равняется отношению изменения количества вещества в единице объёма, т. е. изменения концентрации, к промежутку времени, в течение которого оно произошло:
Истинная скорость реакции в данный момент выражается изменением концентрации, отнесенным к бесконечно малому промежутку времени, т.е. производной концентрации по времени.
18.
К факторам, влияющим на скорость реакции, относятся природа реагентов, катализатор, температура, концентрация реагентов.
Ø Природа реагентов. Здесь большую роль играет характер химических связей в соединениях, строение их молекул.
Чем больше поверхность соприкосновения реагирующих веществ, тем быстрее протекает реакция. Поверхность твердого вещества может быть увеличена путем его измельчения или растворения (если вещество растворимо). Реакции в растворах протекают практически мгновенно.
Ø Концентрация реагентов. Чтобы произошло взаимодействие, частицы реагирующих веществ в гомогенной среде должны столкнуться. Число столкновений пропорционально числу частиц реагирующих веществ в объеме реактора, т.е. молярным концентрациям этих веществ.
Чем большие количества веществ взяты для реакции в данном объеме системы, т.е. чем выше концентрация реагентов, тем больше число столкновений частиц и тем больше скорость реакции. Зависимость скорости реакции от концентрации реагентов распространяется на газовые смеси и растворы.
Установлено, что:
Ø Скорость химической реакции прямо пропорциональна произведению молярных концентраций реагентов
19..
Молекулярность простых реакций
- мономолекулярные (I2 " I + I)
- бимолекулярные (I2 + H2 " 2HI)
- тримолекулярные (O2 +2H2 =2 H2O)
Мономолекулярная реакция — реакция, в элементарном акте которой превращается одна частица (молекула, радикал, ион); бимолекулярная реакция — реакция, в которой претерпевают превращения две частицы (молекула, радикал, ион); тримолекулярная реакция — реакция, протекающая с участием трех частиц при их одновременном столкновении.
Порядок простых реакций – число, равное сумме показателей степеней концентраций реагирующих веществ в уравнении для скорости реакции.
• 0 порядок: CaCO3(тв.)= CaO+CO2
V=k
• I порядок: а) I2 " I + I
Vпр.р.=k [I2 ]
б) Zn (тв.) +H2SO4 (р-р) = ZnSO4 (р-р) + H2(г)
Vпр.р.=k[H2SO4]
• II порядок: а) Cl2 (г) +H2(г) =HCl(г)
Vпр.р.=k [Cl2 ]∙ [H2]
б) Zn (тв.) +2HCl(р-р) = ZnCL2 (р-р) + H2(г)
Vпр.р.=k[HCl] 2
• III порядок: 2SO2 (г) +O2(г) =2SO3(г)
Vпр.р.=k [SO2 ]2∙ [O2]
20.
Для газовых реакций известно, что при повышении t на каждые 100 скорость химической реакции увеличивается в 2-4 раза (правило Вант-Гоффа).
V2= V1*ϒ 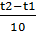
ϒ- температурный коэффициент скорости реакции
При повышении температуры возрастает число активных молекул, т.е. таких молекул, которые в момент столкновения обладают большей энергией и могут образовывать продукты.
Как показывают исследования, активных молекул в реакционной среде при обычных условиях очень мало.
В живом организме химические процессы всегда идут с участием сложных ферментных систем, активность которых в свою очередь зависит от температуры. При повышении температуры фермент уменьшает свою каталитическую активность, поэтому скорость реакции тоже уменьшается.
21.
ЭНЕРГИЯ АКТИВАЦИИ – та минимальная дополнительная энергия, которую необходимо сообщить молекулам сверх среднего её значения.
Активные молекулы – молекулы, обладающие энергией.
Теория активных столкновений основана на том, что химическое взаимодействие осуществляется только при столкновении активных частиц, которые обладают достаточной энергией для преодоления потенциального барьера реакции и ориентированы в пространстве друг относительно друга. Чтобы произошла реакция, частицы в момент столкновения должны обладать некоторым минимальным избытком энергии, называемым энергией активации.
В теории активных столкновений считается, что акт превращения начальных веществ в конечные продукты совершается в момент столкновения активных молекул и протекает мгновенно. При этом молекулы рассматриваются как бесструктурные частицы, хотя в действительности химические реакции происходят путем постепенной перестройки молекул и перераспределения энергии между химическими связями.

22.
Сложная реакция представляет собой совокупность элементарных р-ций, природа и последовательность к-рых составляют механизм реакции. Реакция, протекающая в несколько стадий.
Радиационно-химические реакции - совокупность химических и физико-химических превращений веществ, инициированная действием ионизирующего излучения. В газовой фазе первичными продуктами являются ионы и возбужденные короткоживущие молекулы. Реагируя с молекулами среды и друг с другом, они приводят к образованию свободных радикалов, ион-радикалов и разнообразных стабильных продуктов. В облученных водных растворах образуются радикалы ОН, Н., H2, Н2О2 и ионы Н3 О+. В твердых телах происходит отрыв отдельных атомов, а также процессы деструкции и разложения. Примером радиационно-химической реакции является образование озона: 3О2 2О3.
Радиолиз воды:
- H2O + γ " H2O+ + ē
- H2O + ē " H2O-
- H2O + H2O+" H3O++O•H
- O•H + O•H" H2O2 (сильнейший кроветворный яд)
- H2O-" OH- + H• биохимические реакции
- H•+ H•" H2
- H•+ O•H" H2O и т.д.
В общих чертах этот процесс можно представить так:
· Радиация ионизирует воду
· «вырывает» из молекулы воды электрон.
· Этот электрон соединяется с другой молекулой воды
· и превращается в гидратированный электрон, обладающий большой способностью вступать в химические реакции.
· Положительно заряженная молекула воды, потерявшая электрон, взаимодействует с окружающими ее молекулами
· в результате чего образуются так называемые свободные радикалы — соединения, которые также обладают высокой химической активностью.
· В результате взаимодействия радикалов, в частности, образуется перекись водорода
· которая обладает окислительными свойствами.
Под действием радиации в клетках живых организмов образуются чужеродные химические соединения. Продукты радиолиза «атакуют» молекулярные структуры клеток, разрушают их, прерывают нормальное течение внутриклеточных процессов. В итоге, нормальное функционирование клеток нарушается, и при определенных дозах они гибнут. Но клетки человеческого организма обладают способностью «залечивать» радиационные повреждения.
23.
Большое влияние на скорость реакции оказывают катализаторы - вещества увеличивающие скорость реакции (часто от нуля до очень больших значений), но не входящие в состав продуктов.
Катализ - увеличение скорости реакции под влиянием катализаторов.
Ингибиторы - отрицательные катализаторы, которые, наоборот, замедляют нежелательные химические реакции (например, коррозию металлов).
Различают 2 типа катализа:
Ø Положительный, когда скорость реакции увеличивается
Ø Отрицательный, когда скорость реакции уменьшается.
Все каталитические реакции подразделяют на гомогенные и гетерогенные:
Ø Если реагирующие вещества и катализатор находятся в разных фазах, катализ называется гетерогенным. (синтез аммиака из азота и водорода в присутствии металлического железа)
Ø Если реагирующие вещества и катализатор находятся в одной фазе, то катализ называется гомогенным. (разложением водородпероксида в присутствии солей Fe(2) в водных растворах)
Особенности биокатализаторов
-высокая эффективность:
а) 2H2O2 " 2H2O +O2 (Ea = 75 кДж/моль)
каталаза
б) 2H2O2 " 2H2O +O2 (Ea = 23 кДж/моль)
V химической реакции увеличивается в 3 ● 1011 раз
- ориентационный эффект (повышает скорость биохимических реакций примерно в 1000 раз)
-полифункциональный эффект (одновременное действие на молекулу субстрата нескольких активирующих групп фермента)
-специфичность действия (один фермент катализирует только одну биохимическую реакцию или её стадию)
-действует в условиях постоянных температур (10◦-60◦С)
- действие ферментов зависит от pH среды (pH=4-10)
Ферментативный катализ играет огромную роль в жизнедеятельности организма. Широкое применение получили ферментные препараты при нарушениях функции желудочно-кишечного тракта, связанных с недостаточной выработкой пищеварительных ферментов (пепсин, панкреатин). При ожогах, гнойных ранах, гнойно-воспалительных заболеваниях легких, когда необходимо разрушить накопившиеся в большом количестве белковые образования, применяются протолитические ферменты, приводящие к быстрому гидролизу белков и способствующие рассасыванию гнойных скоплений. Для лечения инфекционных заболеваний используются препараты лизоцина, которые разрушают оболочку некоторых болезнетворных бактерий. Очень важные ферменты, которые рассасывают тромбы (сгустки крови внутри кровеносных сосудов) – плазмин, трипсин, химотрипсин, на их основе с разными добавками созданы различные лекарственные препараты – стрептокиназа, стрептаза, и т.п., широко применяемые в медицине.
Выделения ферментов в особый класс катализаторов обусловлен особыми свойствами этих веществ:
1) высокая специфичность;
2) эффективность действия;
3) биологические катализаторы образуются и разрушаются в процессе жизнедеятельности организма.
24.
Реакции, которые протекают только в одном направлении и завершаются полным превращением исходных реагирующих веществ в конечные вещества, называются необратимыми.
Обратимыми называются такие реакции, которые одновременно протекают в двух взаимно противоположных направлениях.
Допустим, протекает некая обратимая химическая реакция:
а А + b В = с С + d D тогда, исходя из закона действующих масс, запишем выражения для скорости прямой υ1 и обратной υ2 реакций:
υ1 = k1·[A]a·[B]b
υ2 = k2·[C]c·[D]d
В состоянии химического равновесия, скорости прямой и обратной реакции равны, т.е.:
υ1 = υ2
k1·[A]a·[B]b = k2·[C]c·[D]d
получаем
К = k1/ k2 = [C]c·[D]d ̸ [A]a·[B]b
Где К = k1/ k2 – константа равновесия.
Прогнозирование смещения химического равновесия
(Принцип Ле-Шателье)
Если на систему, находящуюся в равновесии, оказывать внешнее воздействие, то равновесие сместится в сторону той из двух реакций, которая противодействует данному изменению.