Вклад отечественных учёных в развитие теории электролитической диссоциации
Выполнил(а)
Студент(ка) группы ЭПГ 1-17
Меликова Анна Сергеевна
| Изм. |
| Лист |
| № докум. |
| Подпись |
| Дата |
| Лист |
| П.08.02.09.ЭПГ-1-17. ….000 |
1. Понятие электрической диссоциации…………………………………………….. 2
2. Вклад отечественных ученых в развитие теории
электролитической диссоциации…………………………………………………..2
2.1. Иван Алексеевич Каблуков....................................................................................2
2.2. Владимир Александрович Кистяковский……………………………………….3
2.3. Сванте Август Аррениус…………………………………………………………4
3. Из истории создания и развития теории электролитической диссоциации
Список использованных источников………………………………………………...4
| Изм. |
| Лист |
| № докум. |
| Подпись |
| Дата |
| Лист |
| П.08.02.09.ЭПГ-1-17. ….000 |
Понятие электролитической диссоциации для объяснения особенностей водных растворов электролитов было введено шведским ученым С.Аррениусом в 1887 г. В дальнейшем она была развита многими учеными на основе учения о строении атомов и химической связи. Электролитическая диссоциация играет важную роль во многих природных и производственных процессах, определяя, как свойства растворов электролитов, так и особенности происходящих в них процессов.
Понятие электролитической диссоциации
Электролитическая диссоциация, полный или частичный распад молекул растворенного вещества на катионы и анионы. Электролитической диссоциацией называют также распад на катионы и анионы ионных кристаллов при растворении или расплавлении. Электролитическая диссоциация, как правило, происходит в полярных растворителях.
При электролитической диссоциации разрываются обычно лишь наиболее полярные связи молекул, например карбоновые кислоты RCOOH диссоциируют на 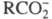 и Н+, электролитической диссоциации могут подвергаться молекулы некоторых растворителей, например воды.
и Н+, электролитической диссоциации могут подвергаться молекулы некоторых растворителей, например воды.
Основными причинами электролитической диссоциации являются, с одной стороны, взаимодействие растворенного вещества с растворителем, которое приводит к сольватации ионов, а с другой стороны - значительное ослабление электростатических взаимодействий между сольватированными ионами в среде, обусловленное ее электростатическим полем (диэлектрической проницаемостью растворителя). При этом работа, необходимая для разрушения молекул (кристаллической решетки), обеспечивается за счет энергии сольватации.
Электролитическая диссоциация лежит в основе деления растворов на два класса - растворы не электролитов и растворы электролитов. Наблюдаемое различие в коллигативных свойствах разбавленных растворов электролитов и не электролитов объясняется тем, что из-за электролитической диссоциации увеличивается общее число частиц в растворе. Это, в частности, приводит к увеличению осмотического давления раствора сравнительно с растворами не электролитов, понижению давления пара растворителя над раствором, увеличению изменения температуры кипения и замерзания раствора относительно чистого растворителя. Электролитической диссоциацией объясняется также ионная электропроводность электролитов.
Вклад отечественных учёных в развитие теории электролитической диссоциации
Иван Алексеевич Каблуков
В 1891 г. в Московском университете была защищена докторская диссертация «Современная теория растворов (Вант-Гоффа и Аррениуса) в связи с учением о химическом равновесии». Защищал ее тридцатичетырехлетний химик Иван Алексеевич Каблуков (1857-1942), ученик В. В. Марковникова, А. М. Бутлерова и Аррениуса, у которого он перед тем проработал год. Каблуков внес существенное усовершенствование в теорию электролитической диссоциации.
В те же годы многие химики, а не одни лишь профессора в Упсале высказывали возражения против теории Аррениуса. Она не давала ясного ответа, почему молекулы распадаются на ионы, каков механизм их образования. Это смущало Д. И. Менделеева и Н. Н. Бекетова, и они новую теорию не признавали. Противниками теории
| Изм. |
| Лист |
| № докум. |
| Подпись |
| Дата |
| Лист |
| П.08.02.09.ЭПГ-1-17. ….000 |
Владимир Александрович Кистяковский
Научные работы посвящены учению о растворах, химической термодинамике, электрохимии. Одним из первых выдвинул (1888) идею объединения гидратной теории растворов Д. И. Менделеева и теории электролитической диссоциации Оствальда. Одновременно и независимо от И. А. Каблукова ввёл (1889-1891) представление о сольватации ионов. Открыл (1904) правило, связывающее зависимость высоты капиллярного поднятия жидкости при температуре кипения от молекулярной массы (правило Кистяковского). Вывел формулу, связывающую упругость пара в капиллярах с величиной поверхностного натяжения и молекулярной массой жидкости. Установил зависимости между молярными величинами теплоты испарения и объёма пара при температуре кипения (1916), коэффициентом сжимаемости и внутренним давлением жидкости (1918), теплотой испарения и температурой кипения неассоциированной жидкости (1922), теплотой плавления и числом атомов в молекуле (1922). Составил теоретически обоснованную таблицу электродных потенциалов и выполнил исследования в области электрохимии магния, хрома, железа, алюминия и др. металлов (1910). Развил представления о процессах коррозии металлов и электрокристаллизации металлов с образованием на их поверхности тонкой защитной плёнки, непроницаемой для атмосферного кислорода. Исследовал (1929-1939) явления коррозии при полифазном контакте. Результаты исследований Кистяковского нашли применение в практике защиты металлов от коррозии, в техниках гальваностегии и рафинирования металлов.
Из истории создания и развития теории электролитической диссоциации
На протяжении всей истории развития химических знаний растворы постоянно были предметом изучения. Способность растворов многих веществ проводить электрический ток была открыта М. Фарадеем в начале XIX в. Гипотезы о диссоциации веществ на ионы высказывались К. Гротгусом (1805), А.У. Уильямсоном (1851), Р. Клаузиусом (1857), Г. Гельмгольцем (1 882). Однако все они ограничивались лишь предположением, не давая развернутых доказательств этой идеи. Например, немецкий физик Гельмгольц полагал, что все электролиты в растворах полностью распадаются на ионы. Однако эта гипотеза не объясняла, например, факта увеличения электропроводности растворов по мере их разбавления, как и многих других фактов, обнаруженных в экспериментальных исследованиях.
К 80-м годам XIX в. в науке накопилось много фактов, характеризующих поведение растворов, но не поддающихся объяснению.
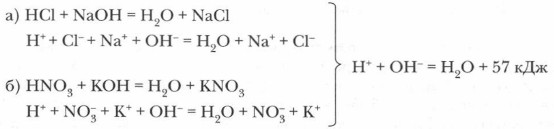
Например, не удавалось объяснить, почему реакция нейтрализации между разными кислотами и щелочами в тех случаях, когда на 1 моль щелочи приходится 1 моль кислоты, всегда сопровождается одинаковым тепловым эффектом, равным 57 кДж.
Было установлено также, что растворы замерзают при более низкой температуре, чем чистые растворители. При этом понижение температуры замерзания всегда пропорционально числу частиц растворенного в единице объема вещества. Так, при растворении в 1000 г растворителя 1 моль вещества температура замерзания должна понижаться на 1,86 °С. Однако при определении температуры замерзания электролитов было обнаружено много несоответствий этим расчетно-экспериментальным данным. Например, раствор хлорида натрия, содержащий 1 моль вещества в 1 000 г растворителя, замерзает не при -1,86 °С, а при -3,36 °С.
 Подобных фактов было накоплено немало. Требовалось дать им объяснение на основе новой системы теоретических взглядов.
Подобных фактов было накоплено немало. Требовалось дать им объяснение на основе новой системы теоретических взглядов.
Эту задачу и решил 29-летний шведский исследователь С.А. Аррениус. Многочисленные опыты и наблюдения, проведенные Аррениусом, а также научные результаты, полученные его коллегами (в первую очередь — теория разбавленных растворов Вант-Гоффа), позволили ему сформулировать положения физической теории электролитической диссоциации, согласно которым:
вещества делятся на электролиты и не электролиты;
при растворении в воде электролиты диссоциируют на ионы;
образующиеся ионы и молекулы растворителя находятся в состоянии неупорядоченного теплового движения.
Эти положения объясняли многое, например, перечисленные выше непонятные факты.
Пример 1. Одинаковое значение теплового эффекта реакций нейтрализации объясняется тем, что сущность всех таких реакций сводится к одному и тому же процессу: связыванию протонов и гидроксид-ионов и образованию молекул воды и, естественно, характеризуется одним и тем же тепловым эффектом:
| Изм. |
| Лист |
| № докум. |
| Подпись |
| Дата |
| Лист |
| П.08.02.09.ЭПГ-1-17. ….000 |
Пример 2. Понижение точки замерзания растворов электоролитов происходит пропорционально числу частиц, содержащихся в растворе. Так, при диссоциации одного моля хлорида натрия образуются два моля ионов:
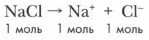
Причин диссоциации Аррениус не раскрыл. Теории электролитической диссоциации было суждено пройти путь от полного неприятия большинством ученых до полного признания. Д.И. Менделеев принадлежал к категорическим противникам идей Аррениуса и отстаивал идею образования соединений из молекул растворенного вещества и растворителя, т. е. предполагал, что растворы имеют химическую природу. Химическая, или гидратная, теория растворов противопоставлялась теории Аррениуса (физической). В дальнейшем синтез идей этих двух теорий привел к созданию современной теории растворов. Огромная роль в создании гидратной теории принадлежит представлениям о химической сущности процесса растворения, обоснованным русскими ученымиИ.А. Каблуковым и В.А. Кистяковским.
Ссылки на источники литературы
| Изм. |
| Лист |
| № докум. |
| Подпись |
| Дата |
| Лист |
| П.08.02.09.ЭПГ-1-17. ….000 |
https://megaobuchalka.ru/9/36281.html
https://лена24.рф/Химия_9_класс_Кузнецова/6.1.html
https://www.physchem.chimfak.rsu.ru/Source/History/Persones/Kistyakovskii.html