Занятие № 5
Тема. Периодический закон и периодическая система Д.И. Менделеева. Связь со строением атома
Цель: научится свободно пользоваться таблицей для установления строения атома, закономерностей изменения свойств химических элементов.
После изучения темы студент должен
знать:
1. структуру периодической таблицы, физический смысл;
2. характер изменения свойств химических элементов:
- радиусов;
- ионизационного потенциала;
- сродства к электрону;
- электроотрицательности.
3. характер изменения свойств простых веществ и химических соединений:
- изменения степени металличности, неметалличности;
- окислительно – восстановительных свойств;
- кислотно-основных свойств оксидов и гидроксидов.
уметь:
1) объяснять связь периодической системы со строением атома и химическими свойствами простых веществ и химических соединений;
2) давать характеристику химического элемента по положению его в периодической системе;
3) составлять формулы бинарных соединений по максимальной и минимальной валентности.
Вопросы для обсуждения на занятии
1. Сформулировать периодический закон и объяснить его физический смысл на основании строения внешних и предвнешних слоев:
а) что значит: «свойства периодически повторяются»?;
б) чем объясняется такое повторение свойств?
2. Какова структура периодической системы. В чем физический смысл атомного номера, периода, группы?
3. Как изменяются в периодической системе радиусы, потенциал ионизации и сродство к электрону.
4. Как изменяются металлические и неметаллические свойства простых веществ? Положение металлов и неметаллов в ПС.
5. Как изменяются кислотно-основные свойства оксидов и гидроксидов в ПС?
6. Как определить степень окисления – высшую и низшую - по положению в ПС?
Задания для усвоения учебного материала (на занятии)
1. Составить электронные конфигурации атомов химических элементов кальция, фосфора, меди, селена.
Объяснить для этих элементов:
1) принадлежность к S, P, d, d – семействам;
2) металлические и неметаллические свойства;
3) окислительно-восстановительные свойства простых веществ;
4) составить формулы возможных бинарных соединений;
5) написать оксиды этих элементов по высшей степени окисления;
6) написать гидроксиды этих элементов, установить их характер.
2. Расположите в порядке уменьшения электроотрицательности следующие элементы: азот, кислород, фтор, хлор.
3. Составьте формулы ванадиевой кислоты, высшего оксида вольфрама, водородного соединения кремния.
4. Какой из гидроксидов обладает более сильными основными свойствами?
5. Сравните потенциал ионизации и сродство к электрону у следующих пар атомов: азот и кислород, фтор и хлор.
Примеры тестовых заданий.
- В третьем периоде с увеличением атомного номера химического элемента в целом происходит:
1) уменьшение атомного радиуса;
2) уменьшение энергии ионизации;
3) увеличение энергии ионизации;
4) увеличение высшей валентности.
Ответ: 1, 3, 4
1 – т.к. радиус уменьшается вследствие увеличения заряда ядра.
3 – т. к. с увеличением заряда ядра появляются новые электроны, требуется больше энергии, чтобы оторвать от нейтрального атома электрон.
4 – т. к. увеличивается число ē, которые могут участвовать в образовании связей.
2. Укажите символ химического элемента, атом которого имеет 5 электронных слоев и образует высший оксид ЭО3.
1) S; 2) Se; 3) Te; 4) Sb
Ответ: 3 – т. к. элемент стоит в пятом периоде, т. к. n = 5. Высший оксид говорит о том, что валентность элемента равна 6, потому группа – 6. Т.о. это теллур.
3. Энергия сродства к электрону последовательно возрастает в ряду элементов, химические символы которых:
1) P, S, Cl; 2) Cl, S, P; 3) P, Cl, S; 4) S, P, Cl
Ответ: 1, т. к. чем больше электронов, тем энергетически выгодно завершить оболочку до устойчивого состояния. Наоборот, полностью или наполовину заполненная оболочка имеет отрицательное значение сродства к электрону.
4. Укажите верные характеристики элемента, электронная конфигурация атома которого 1s22s22p63s23p63d34s2
1) металл; 2) находится в 3-м периоде;
3) имеет 5 валентных электронов;
4) расположен в 5В группе.
Ответ: 1, т.к. заполняются 3d -орбитали, …это d - металл;
3,4 – т.к. 3d электрона и 2-s электрона валентного слоя 3d3 и 4s2 в сумме дают 5 электронов, потому 5-я группа, валентность равна 5.
5. Атому Э2- отвечает электронная конфигурация атома аргона. Укажите формулы водородного соединения и высшего оксида элемента.
1) ЭН3 и Э2О5 3) ЭН и Э2О7
2) ЭН2 и ЭО3 4) ЭН и ЭО2
Ответ: 2, т.к. электронной конфигурации аргона соответствует структура последнего слоя 3s23p6, но для искомого атома следует отнять 2ē, получится 3s23p4. Это сера следовательно летучее соединение H2S, а оксид SO3.
6. Радиус частиц последовательно уменьшается в рядах:
1) К, Са,Са2+; 2) К, К, + Са2+; 3) К, Са, К+; 4) К, К+,Са2+;
Ответ:1 – так как кальций стоит во второй группе, поэтому радиус у него больше, чем калий, который стоит в первой группе. У катиона кальция радиус меньше, чем у атома кальция. 3 – так как ион калия имеет оболочку 4S0, а Са – 4S2 /
7. Свойства оксидов в последовательности основный, амфотерный, кислотный изменяется в ряду
1) Na2O, SO3, Al2O3;
2) Na2O, Al2O3, SO3;
3) Si2O, CaO, ZnO;
4) BaO, P2O5, Cl2O5.
Ответ: 2
8. Энергия связи в молекуле брома равна 190кДж/моль, а энергия сродства к электрону атомов брома составляет 325 кДж/моль. В процессе Br2(г) → 2Br– для брома массой 1,6 г
1) выделяется 6,5 кДж энергии;
2) поглощается 6,5 кДж энергии;
3) выделяется 4,6 кДж энергии;
4) поглощается 4,6 кДж энергии;
Ответ: 3. Решение. Чтобы превратить молекулу в два атома следует затратить 190 кДж., т.е. энергия поглощается. n (Br) = 1,6/160=0,01моль; следовательно,
Q = n · Qм =190·0,01= 1,9 кдж. Q(сродства к электрону) = 325·0,01=3,25. Следовательно, суммарное тепловой эффект процесса равен 6,5 –1,9 =4,6 еДж энергии.
9. Число одинаковых характеристик из перечисленных (радиус атома, число электронных слоев, число валентных электронов, формула летучего водородного соединения, энергия ионизации) для элементов хлора, брома, иода равна
1) 5; 2) 4; 3) 3; 4)2.
Ответ: 4. Здесь только две одинаковые характеристики: число валентных электронов, равное 7, формула летучего соединения HГ.
- Справедливыми являются утверждения:
1) энергия сродства к электрону для атомов хлора больше, чем для аниона хлора;
2) эгнргия отрыва второго элеткрогна для атомов калия больше, чем для атомов кальция;
3) энергия ионизации ионов натрия больше, чем атомов натрия;
4) радиус катиона кальция больше, чем радиус атома аргона.
Ответ: 1,2,3. 1 – т.к. к отрицательному аниону Сl– электрон присоединить очень трудно, вследствие отталкивания от уже имеющегося.
2– т.к. второй электрон у калия отрывается с орбитали завершенной, типа аргона, а у кальция от орбитали 4S2;
3) – т.к. электрон с орбитали 3S1 у натрия легко оторвать до устойчивого слоя, а у Na+ – оболочка типа неона очень устойчива.
Лабораторная работа
РЕАКТИВЫ:
1) сера кристаллическая – 1 экз.;
2) красный фосфор – 1 экз.;
3) р-р NaOH 2н – в каждом шкафу;
4) р-р HCl 2н – в каждом шкафу;
5) аллюминевая фольга; железные опилки.
ОБОРУДОВАНИЕ:
1) колбы конические – 2 (см. рис. 1);
2) ложечки для сжигания с пробками – 2;
3) спиртовка, спички;
4) набор пробирок на одну пару студентов.
Опыт 1 (лабораторный)
Ход работы. Рассмотреть внешний вид веществ: серы, фосфора, железа, аллюминия.
1. Как определить металлический и неметаллический характер этих веществ.
2. Составить электронные конфигурации этих элементов.
3. Определить высшую валентность и составить оксиды и соответствующие гидроксиды данных элементов.
Опыт 2 (лабораторный)
Ход работы. Опустить кусочки железа и аллюминия в раствор щелочи и кислоты. Описать явления и сделать выводы.
Опыт 3. (демонстрационный)
Ход работы. В ложечке для сжигания сжечь серу и фосфор над водой, подкрашенной лакмусом.
1. Объяснить явления.Составить уравнения реакций. Сделать вывод какой характер оксидов подтверждает данный опыт.
Рис.1
Нейтрализация: р-ром Na2CO3порциями до нейтральной среды. Слить в канализацию.
Опыт 4. (лабораторный)
Получить гидроксиды аллюминия и магния, взаимомействием с раствором хлоридов с раствором щелочи. Разлить каждый гидроксид в две пробтрки (см. рис. 2).
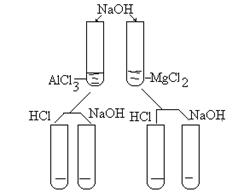
Рис. 2
В одну пробирку с осадком добавить по каплям р-р кислоты, в другую - р-р щелочи. Сделать выводы о характере гидроксидов. Отходы опыта слить в склянку для дальнейшего обезвреживания.
Сформулировать выводы о свойствах гидроксидов магния и алюминия.