Предыдущие крупномасштабные исследования секвенирования неоднократно показывали, что некоторые предполагаемые менделевские болезнетворные генетические варианты неправдоподобно распространены в популяции 21 , 22, 23 (рис. 4c). Средний участник ExAC содержит ~54 варианта, сообщенных как вызывающие заболевание в двух широко используемых базах данных вызывающих заболевание вариантов (дополнительная информация раздел 5.2). Большинство из них (~41) являются высококачественными генотипами, но с неправдоподобно высокими (>1%) частотами аллелей popmax. Поэтому мы предположили, что большая часть предполагаемого бремени аллелей Менделевского заболевания на одного человека вызвана не ошибкой генотипирования, а скорее ошибочной классификацией в литературе и/или в базах данных.
Мы вручную обработали доказательства патогенности для 192 ранее сообщенных патогенных вариантов с частотой аллелей >1% либо в глобальном масштабе, либо в Южной Азии или латиноамериканских лицах, популяциях, которые недопредставлены в предыдущих справочных базах данных. Девять вариантов имели достаточные данные для поддержки Ассоциации заболевания, как правило, с легкими или неполно проникающими последствиями заболевания; остальные либо имели недостаточные доказательства патогенности, не претендовали на патогенность, либо были доброкачественными признаками (дополнительная информация раздел 5.3). Трудно доказать отсутствие какой-либо ассоциации заболевания, и в некоторых случаях неполное проникновение или генетические модификаторы могут способствовать этому. Тем не менее, высокая кумулятивная частота аллелей этих вариантов в сочетании с их ограниченными исходными данными о патогенности свидетельствуют о незначительном вкладе в развитие заболевания, и 163 варианта соответствовали критериям Американского колледжа медицинской генетики 24 для переклассификации в доброкачественные или, вероятно, доброкачественные (Рис.2). 4d). В общей сложности 126 из этих 163 были реклассифицированы в базах данных-источниках по состоянию на декабрь 2015 года (дополнительная таблица 20). Опорные функциональные данные были представлены для 18 из этих вариантов, что подчеркивает необходимость осторожного рассмотрения даже вариантов с экспериментальной поддержкой.
Мы также искали фенотипические данные для подгруппы участников ExAC, гомозиготных для зарегистрированных тяжелых рецессивных вариантов заболевания, что опять же позволило переклассифицировать некоторые варианты как доброкачественные. Североамериканский Индийский детский цирроз-это рецессивное заболевание цирротической печеночной недостаточности в детском возрасте, требующее пересадки печени для выживания во взрослом возрасте, ранее сообщалось, что оно вызвано CIRH1A p.R565W 25 (CIRH1A также известен как UTP4). Всего было выявлено 222 гетерозиготных и 4 гомозиготных латиноамериканских индивида с частотой встречаемости популяционного аллеля 1,92%. У 4 гомозигот в анамнезе не было заболевания печени, а у двух человек в результате повторного контакта была выявлена нормальная функция печени (дополнительная таблица 22). Таким образом, несмотря на строгую увязку и усилия по секвенированию Sanger, которые привели к первоначальному докладу о патогенности, данные ExAC показывают, что этот вариант является либо доброкачественным, либо недостаточным для того, чтобы вызвать заболевание, подчеркивая важность сопоставимых референтных популяций.
Вышеизложенные исследования подтверждают важность фильтрации частот аллелей при анализе вариантов 6 , 26 , 27 кандидозного заболевания. Однако ошибки в литературе и базах данных превалируют даже при более низких частотах аллелей: средняя частота аллеля popmax составляет 0,89 (<1% частоты аллеля popmax) в хорошо охарактеризованных генах доминантного заболевания 28, а 0,21 при Эта инфляция, вероятно, является результатом сочетания ложных сообщений о патогенности и неполной пенетрантности, как мы недавно показали для PRNP 29. Обилие редких функциональных вариаций во многих генах болезни в ExAC является напоминанием о том, что такие варианты не следует считать причинными или высокопротеинантными без тщательной сегрегации или анализа случай-контроль 7, 24.
Действие редких белковых усекающих вариантов
Мы исследовали распределение PTVs, вариантов, предсказанных для нарушения белок-кодирующих генов путем введения стоп-кодона, сдвига фреймов или нарушения существенного участка соединения; такие варианты, как ожидается, будут обогащены для полной потери функции затронутых генов. Естественные PTVs у человека служат моделью для функционального воздействия инактивации генов и используются для идентификации многих генов, в которых LoF вызывает тяжелое заболевание 30, а также в редких случаях, когда LoF защищает от заболевания 31.
Среди 7404 909 высококачественных вариантов в ExAC мы обнаружили 179 774 высоконадежных PTV (как определено в разделе дополнительной информации 6), 121 309 из которых являются синглетами. Это соответствует в среднем 85 гетерозиготным и 35 гомозиготным PTV на человека (Рис.1). 5а). Разнообразный характер когорты позволяет обнаружить значительное число новых PTV: из 58 435 PTV с числом аллелей, превышающим один, 33 625 встречаются только в одной популяции. Однако, хотя PTV как категория чрезвычайно редки, большинство PTV, найденных в любом одном человеке, являются общими, и каждый индивид имеет только ~2 синглетных PTV, из которых 0,14 находятся в PTV-ограниченных генах (pLI > 0,9). ExAC резюмирует известные аспекты демографических моделей населения, включая увеличение промежуточной частоты (1-5%) ПТВ в Финляндии 32 а также относительно часто встречающиеся (>1%) ПТВ у африканцев (>фиг. 5b). Однако эти различия уменьшаются при рассмотрении только LoF-ограниченных (pLI > 0.9) генов (> расширенные данные Рис.2). 4).
Рисунок 5: изменение усечения белка в ExAC.

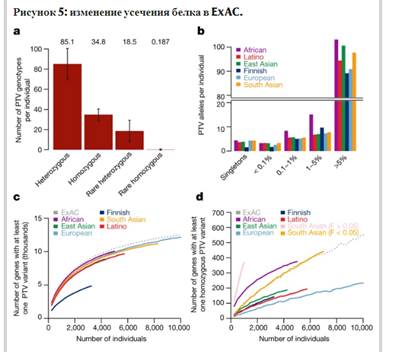
а, средний индивидуум ExAC имеет 85 гетерозиготных и 35 гомозиготных белок-усекающих вариантов (PTVs), из которых 18 и 0,19 являются редкими (Полосы ошибок представляют собой стандартное отклонение. b, разбивка PTVs на индивида (a) по частоте аллеля popmax bin. Во всех популяциях большинство PTV, обнаруженных у данного индивида, являются общими (>5% частоты аллелей). c, d, число генов, имеющих по меньшей мере один PTV (c), или гомозиготных PTV (d), в зависимости от количества лиц, уменьшенных от ExAC. Южноазиатская популяция разделена по родству (коэффициент инбридинга, F). На 60 000 особей для ExAC участки в c, d расширяются до 15 750 С по крайней мере одним PTV и 1550 генов с по крайней мере одним гомозиготным PTV. Пунктирная линия представляет все образцы ExAC.
слайд PowerPoint