Лекция № 8
1. Буферные растворы.
2. Равновесия в растворах комплексных соединений.
3. Гетерогенное равновесие в системе осадок/раствор.
3.1. Растворимость. Общие условия растворимости.
3.2. Факторы, влияющие на растворимость.
1. Буферные растворы. Растворы, рН которых относительно мало изменяется при добавлении небольших количеств сильных кислот, оснований и при разбавлении, называются буферными.
Буферные растворы состоят из слабых кислот или оснований и их солей, например, ацетатный буферный раствор – смесь уксусной кислоты и ацетата натрия, аммиачный буферный раствор – смесь аммиака и хлорида аммония.
Рассмотрим на примере ацетатной буферной системы механизм буферного действия. В растворе уксусной кислоты и ацетата натрия осуществляются процессы диссоциации:
СН3СООН «СН3СОО- + Н+ (5)
СН3СООNa → СН3СОО- + Na+.
При добавлении сильной кислоты анион СН3СОО- связывает добавочные ионы водорода, превращаясь в слабую уксусную кислоту:
СН3СОО- + Н+ «СН3СООН. (6)
При добавлении щелочи протоны уксусной кислоты нейтрализуют добавочные гидроксид-ионы, связывая их в молекулы воды:
СН3СООН + ОН- «СН3СОО- + Н2О. (7)
В результате процессов (6) и (7) происходит небольшое изменение в соотношении концентраций слабой кислоты и ее соли, а, следовательно, незначительно изменяется рН.
Способность буферных растворов сохранять постоянство рН ограничена. Прибавлять кислоту и щелочь, существенно не меняя рН буферного раствора, можно лишь в ограниченных количествах. Величину, характеризующую способность буферного раствора противодействовать изменению реакции среды при добавлении сильных кислот или оснований, называют буферной емкостью раствора.
Буферная емкость определяется числом молей эквивалентов сильной кислоты или щелочи, которое при добавлении к буферному раствору изменяет его рН на единицу.
Буферная емкость увеличивается с повышением концентраций компонентов буферного раствора и максимальна при их соотношении 1:1.
Буферирование играет важную роль в природе и технике. К числу исключительных свойств живых организмов относится их способность поддерживать постоянство рН биологических жидкостей, тканей и органов – кислотно-основный гомеостаз. Это постоянство обусловлено наличием нескольких буферных систем. Так, кислотно-основное равновесие в крови человека обеспечивается гидрокарбонатной, фосфатной и белковой буферными системами (нормальное значение рН плазмы крови 7,4 ± 0,05).
Мало изменяется рН морской воды (рН 8,0). При проведении многих технологических процессов рН среды поддерживают постоянным с помощью буферных систем.
2. Равновесия в растворах комплексных соединений. Суммарное равновесие (заряды в нем для простоты опущены):
MeLn «Me + nL (8)
характеризуется константой, называемой константой нестойкости – Кнест:
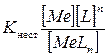 . (9)
. (9)
В действительности диссоциация комплексов происходит стадийно, каждой стадии соответствует своя константа нестойкости, а их произведение дает константу нестойкости суммарного процесса. Кроме констант нестойкости или их силовых показателей – рКнест, в справочной литературе встречаются обратные им величины, описывающие процесс образования комплексов, – константы устойчивости, обозначаемые b.
3. Гетерогенное равновесие в системе осадок/раствор. Предположим, что некоторое труднорастворимое вещество AmBn поместили растворитель, например воду. Под действием растворителя часть ионов и (или) молекул вещества будет переходить в раствор, а из раствора под действием притяжения противоположно заряженных ионов кристаллической решетки или полярных молекул будет осаждаться на поверхности твердой фазы. В результате протекания противоположных процессов растворения и осаждения в системе установится равновесие, при котором скорости этих процессов будут равны. Раствор, находящийся в равновесии с соответствующей твердой фазой, называется насыщенным.
В том случае, когда растворяется малорастворимый электролит схему гетерогенного процесса можно представить в виде:
AmBn (тв) «mA + nB. (10)
Для простоты заряды в (1) опущены.
Константа равновесия (10), выраженная через концентрации ионов, будет равна:
 , (11)
, (11)
Поскольку концентрацию твердого вещества AmBn принято считать равной единице. Из уравнения (11) следует правило произведения растворимости: произведение концентраций ионов в степенях, равных стехиометрическим коэффициентам, в насыщенном растворе малорастворимого электролита есть величина постоянная для данного растворителя, температуры и давления.
В справочной литературе указаны термодинамические ПР – Ks0.
3.1. Растворимость. Общие условия растворимости. Это общая концентрация вещества в его насыщенном растворе. То есть растворимость складывается из концентраций всех форм, в которых данное вещество существует в растворе. Это могут быть сольватированные ионы, продукты побочных реакций, разнообразные ассоциаты, в том числе нейтральные молекулы AmBn. Если в растворе находятся только ионы осадка и, возможно, продукты их побочных реакций, то говорят об ионной растворимости.
При растворении осадка AmBn его ионы переходят в раствор в стехиометрических количествах:
AmBn (тв) «mA + nB
s моль ms моль ns моль
Если в 1 л раствора перешло s моль AmBn, то в насыщенном его растворе равновесные концентрации ионов А и В – [A] = ms и [B] = ns моль/л. Подставляя эти концентрации в выражение Ks, получим связь молярной растворимости (s, моль/л) с реальной константой произведения растворимости.
 ,
,  . (12)
. (12)
В растворе малорастворимого электролита типа АВ:
 . (13)
. (13)
По правилу произведения растворимости, когда произведение концентраций ионов малорастворимого соединения достигает значения его ПР при заданных условиях раствор становится насыщенным относительно этого электролита. Если [A][B] < Ks – раствор не насыщен и осадок (если он есть) будет растворяться. В том случае, когда [A][B] > Ks – раствор пересыщен, из него рано или поздно выделится соединение АВ в виде осадка.
Таким образом, для того, чтобы растворить осадок надо уменьшить в растворе концентрации одноименных с ним ионов, а чтобы осуществить осаждение, наоборот, увеличить концентрацию ионов, образующих осадок.
3.2. Факторы, влияющие на растворимость. 1. Эффект одноименного иона. Ненасыщенный раствор электролита можно сделать насыщенным и даже пересыщенным, добавляя к нему электролит с одноименным ионом. Действительно, если добавлять к раствору АВ электролит, содержащий ион А, то поскольку Ks = [A][B] – это величина постоянная, при увеличении [A], будет уменьшаться [B]. А поскольку в данном случае именно концентрация иона В определяет растворимость (так как концентрацию иона А мы сами задаем добавлением растворимого электролита, содержащего это ион) [B] = s, то и она будет уменьшаться.
2. Солевой эффект. При увеличении концентрации электролита в растворе малорастворимого соединения его растворимость увеличивается. Оценивая растворимость в присутствии одноименного иона влиянием ионной силы (солевым эффектом), как правило, пренебрегают. Не учитывают также вклад в растворимость ионов, поступающих из осадка, так как их концентрация по сравнению с добавляемым избытком одноименных ионов не значительна.
3. Протекание конкурирующих реакций. Если в раствор, находящийся в динамическом равновесии с осадком, то есть в насыщенный раствор, ввести реагент, способный взаимодействовать с катионом или анионом или и с тем и другим, то в результате взаимодействия равновесная концентрация ионов малорастворимого соединения уменьшится. Чтобы обеспечить концентрацию ионов в растворе, соответствующую ПР, в раствор из осадка должно перейти некоторое количество вещества. Процесс растворения, таким образом, пойдет до полного растворения осадка или до установления удовлетворяющих ПР концентраций ионов.
В зависимости от того, какие реагенты взаимодействуют с ионами малорастворимого соединения, а главное от механизма этого взаимодействия различают растворение вследствие протекания протолитических, О-В реакций и процессов комплексообразования.
4. Влияние других факторов. Поскольку ПР зависит от температуры, от нее зависит и растворимость. В большинстве случаев процессы растворения твердых веществ – эндотермические, поэтому с ростом температуры увеличивается и растворимость. Уменьшение растворимости с повышением температуры встречается редко и связано обычно с изменением кристаллической решетки вещества.
Растворимость зависит от растворителя. Осадки, состоящие из неорганических ионов, как правило, растворимы в воде лучше, чем в органических растворителях. И, наоборот, осадки, содержащие крупные органические фрагменты, лучше растворяются в органических растворителях.
На растворимость влияют также размеры частиц, образующих осадок – чем они меньше, тем больше поверхность осадка, а следовательно, растворимость.