Если два электрода с различными потенциалами соединить через внешнюю цепь, то система выйдет из равновесия и в ней будет протекать электрический ток, способный совершать работу. Химическими источниками тока (ХИТ) называются электрохимические устройства, в основе работы которых лежат окислительно-восстановительные реакции превращения химической энергии в электрическую. Для такого превращения необходимо, чтобы окислительные и восстановительные процессы были разделены пространственно: на одном электроде происходило бы окисление металла, на другом – восстановление и электроны от восстановителя к окислителю переходили через внешнюю цепь. К ним относятся: гальванические элементы (ГЭ), аккумуляторы (А), топливные элементы (ТЭ). Во всех ХИТ используются электролиты: водные, неводные, твердые. Каждый из электродов в ХИТ называется полуэлементом.
Электрод, посылающий электроны во внешнюю цепь, называется отрицательным электродом(анодом), и на нем происходит окисление. Электрод, принимающий электроны из внешней цепи, называется положительным электродом (катодом), и на нем происходит восстановление.
Электрохимическая схема гальванического элемента изображается следующим образом. Вначале записывается материал электрода, имеющий меньший электродный потенциал (отрицательный электрод), затем указывается электролит, в который погружен материал первого электрода. Записи составов электрода и электролита разделяются прямой чертой, условно обозначающей скачок потенциала на границе раздела фаз. После этого в обратной последовательности записываются составляющие второго электрода (положительный электрод). Записи электролитов разделяются двумя вертикальными чертами, условно обозначающими отсутствие скачка потенциала на границе раздела электролитов.
При схематическом изображении гальванического элемента слева записывается анод, а справа - катод. При такой записи поток электронов направлен слева на право, а электродвижущая сила (ε) гальванического элемента определяется как разность равновесных потенциалов катода и анода:
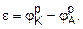
Поскольку гальваническом элементе процессы протекают самопроизвольно, то ∆G<0. Энергия Гиббса связана с электродвижущей силой гальванического элемента соотношением
∆G = –z∙F·e,
где z – число электронов, участвующих в электродных процессах; F – постоянная Фарадея;·e – электродвижущая сила гальванического элемента. В связи с этим электродвижущая сила гальванического элемента должна быть величиной положительной. В основе действия гальванического элемента может быть химический процесс или процесс выравнивания концентраций двух электролитов – растворов одного и того же вещества. По этому критерию гальванические элементы делятся на химические и концентрационные.
Химические элементы – электрохимические системы, в которых электроды могут отличаться по химическим и физическим свойствам. Источником электрической энергии в таких элементах служит энергия окислительно-восстановительных реакций, протекающих на электродах.
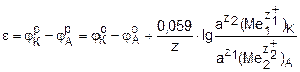
где φоК и φоА – стандартные электродные потенциалы катода и анода; z1 и z2 – число электронов, участвующих, соответственно, в реакциях восстановления и окисления; z – общее число электронов, участвующих в окислительно-восстановительной реакции, z = z1∙z2; 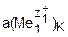 и
и 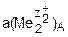 – активности участников электродных реакций, соответственно, в прикатодном и в прианодном пространствах.
– активности участников электродных реакций, соответственно, в прикатодном и в прианодном пространствах.
В случае z = z1 = z2 уравнение принимает вид
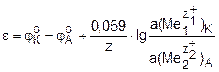 .
.
Примером химического гальванического элемента может быть медно-цинковый элемент, известный как элемент Даниэля – Якоби (рис). Он состоит из медной пластины, опущенной в раствор сульфата цинка, и цинковой пластины, помещённой в раствор сульфата цинка. Сосуды замыкают с помощью U-образной трубки, заполненной раствором электролита. На цинковом электроде устанавливается равновесие
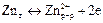 ,
,
а на медном –
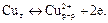

Стандартный восстановительный потенциал цинкового электрода равен -0,763 В, а медного составляет + 0,337 В. Следовательно, при замыкании цепи на цинковом электроде пойдет процесс окисления цинка, а на медном – процесс восстановления ионов меди. Цинковый электрод зарядится отрицательно, а медный электрод приобретет положительный заряд. В электрохимии процессы окисления носят название анодных процессов, соответственно процессы восстановления называются катодными процессами, Электроны будут переходить от цинка к меди, т.е. от анода к катоду. Цинковый анод в результате окисления будет растворяться, и в раствор будут переходить ионы цинка, ионы меди будут восстанавливаться, а металлическая медь – осаждаться на катоде. Увеличение концентрации катионов цинка в анодном пространстве будет компенсироваться переносом отрицательно заряженных сульфат-ионов к аноду. Удаление ионов меди из катодного пространства приведет к дефициту катионов, что вызовет перенос катионов цинка и меди к катоду. Суммарная химическая реакция в гальваническом элементе будет иметь вид
Zn + Cu2+ = Zn2+ + Сu.
Схема гальванического элемента Даниэля – Якоби запишется следующим образом:
Zn|Zn2+||Cu2+|Cu.
Величину стандартной ЭДС гальванического элемента рассчитывают как разность стандартных восстановительных потенциалов катода и анода:
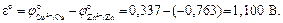
Концентрационные – это электрохимические системы, состоящие из двух электродов с одинаковыми физическими, химическими свойствами и одинаковыми электродными реакциями. Отличие заключается в активностях участников электродных реакций. Источником электродвижущей силы концентрационных цепей является энергия переноса вещества от электрода с большей активностью к электроду с меньшей активностью.
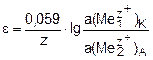 .
.
например: 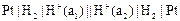 ,
, 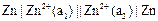
Аккумуляторы отличаются от гальванических элементов тем, что после исчерпания реагентов работоспособность аккумулятора может быть восстановлена пропусканием тока в направлении, обратном направлению тока при работе. Процесс выработки электрической энергии носит название разряд, а процесс восстановления работоспособности аккумулятора – заряд. При разряде химическая энергия превращается в электрическую, а при заряде – электрическая в химическую. Аккумулятор – это гальванический элемент многоразового использования. Наиболее распространенными в настоящее время являются свинцовые аккумуляторы, называемые также кислотными. Электроды кислотного аккумулятора представляют собой свинцовые решетки, заполненные пастой из оксида свинца (IV). Электроды помещают в раствор серной кислоты с концентрацией 32–39 % и отделяют друг от друга пористыми сепараторами. При работе аккумулятора на электродах протекают следующие реакции: анод: 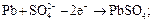
катод: 
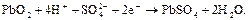
При заряде протекают обратные реакции. Суммарно процессы в свинцовом аккумуляторе можно представить следующим образом:

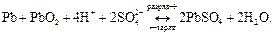
ЭДС свинцового аккумулятора составляет ~2 B.
Основными достоинствами свинцового аккумулятора являются низкая стоимость и высокий КПД, основнными недостатками – большая масса, приходящаяся на единицу электрической емкости, а также относительно малый срок службы – 200 – 500 циклов разряда-заряда.
Железо-никелевый аккумулятор. Анод изготавливается из губчатого железа, катод представляет собой никелевую решетку, заполненную пастой из гидроксида никеля (III) NiOOH и графита. В качестве электролита используют 20% раствор гидроксида калия КОН.При разряде на электродах протекают следующие реакции:
анод: Fe + 2OH- -2e- → Fe(OH)2;
катод: NiOOH + H2O + e- → Ni(OH)2 + OH-.
Суммарно процессы в железо-никелевом аккумуляторе при разряде и заряде можно представить следующим образом:
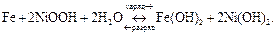
ЭДС железо-никелевого аккумулятора составляет ~1,2 B. Основными преимуществами железо-никелевого аккумулятора являются большой срок службы – до 1000–3000 циклов разряда-заряда и относительно низкая масса, приходящаяся на единицу электрической емкости, основными недостатками – невысокий КПД и низкое рабочее напряжение.
Топливные элементы – это гальванические элементы, требующие в процессе работы расхода окислителя и восстановителя, подаваемых извне. В качестве восстановителя может быть использован водород, природный газ, метанол и др., в качестве окислителя обычно применяют кислород воздуха. Заметного практического применения топливные элементы не нашли.
Кинетика электродных процессов. Электрохимическая поляризация. Уравнение Нернста описывает равновесные электродные процессы, т.е. процессы, протекающие в отсутствие электрического тока. Прохождение электрического тока является неравновесным процессом. Эти процессы изучает раздел электрохимии, называемый кинетикой электродных (или электрохимических) процессов.
Прохождение тока вызывает изменение потенциала электрода. Это явление, а также величина изменения потенциала называются электрохимической поляризацией:
Δφ = φi - φp
где Δφ – поляризация; φi – неравновесный потенциал электрода, т.е. потенциал при прохождении электрического тока; φp – равновесный потенциал.
Изменение потенциала электрода также называют перенапряжением.
Поляризация имеет место, как на катоде, так и на аноде, поэтому различают катодную (Δφк) и анодную (Δφа) поляризации. Катодная поляризация всегда отрицательна, а анодная – всегда положительна.
 Поляризация определяется из экспериментально получаемой зависимости потенциала электрода от плотности тока, т.е. отношения тока I к площади электрода S (i=I/S). График зависимости потенциала от плотности тока носит название поляризационной кривой (рис.).
Поляризация определяется из экспериментально получаемой зависимости потенциала электрода от плотности тока, т.е. отношения тока I к площади электрода S (i=I/S). График зависимости потенциала от плотности тока носит название поляризационной кривой (рис.).
Из кривой следует, что величина поляризации зависит от плотности тока.На поляризацию влияет также материал электрода, состояние его поверхности и целый ряд других факторов.Возникновение поляризации может быть понято из рассмотрения механизма протекания электродных процессов. Электродный процесс состоит из трех основных стадий: 1) подвода реагирующих веществ к электроду; 2) процесса электрохимического превращения на поверхности электрода, который может сопровождаться дополнительными химическими реакциями; 3) отвода продуктов реакции от электрода. Эти процессы протекают последовательно и имеют обычно различные скорости. Скорость наиболее медленной (лимитирующей) стадии определяет общую скорость процесса. Ускорение лимитирующей стадии достигается повышением потенциала электрода, т.е. поляризацией. В зависимости от того, какая стадия является лимитирующей, различают концентрационную и электрохимическую поляризации.
Концентрационная поляризация обусловлена замедленным переносом исходных веществ или конечных продуктов реакций, протекающих на электроде. В результате концентрации исходных веществ в зоне реакции понижаются, а конечных – повышаются. Это смещает равновесие в сторону обратной реакции. Приложение дополнительной разности потенциалов (поляризация) увеличивает скорость переноса компонентов и компенсирует нежелательные процессы. Концентрационная поляризация уменьшается при перемешивании раствора, т.к. это ускоряет выравнивание концентраций компонентов на поверхности электродов.
Электрохимическая поляризация (перенапряжение)обусловлена пониженной скоростью электрохимических реакций на электроде. Согласно современным представлениям наиболее медленной стадией электрохимического процесса является процесс разряда ионов. Это связано с тем, что разряд ионов, как и любая химическая реакция, требует значительной энергии активации, и по этой причине скорость процесса может быть мала.
Скорость электрохимических реакций можно увеличить нагреванием и использованием катализатора, а также повышением потенциала электрода по сравнению с его равновесным значением, т.е. при поляризации. Роль поляризации сводится к уменьшению энергии активации, и величина этого снижения пропорциональна величине поляризации. Уменьшение энергии активации сопровождается увеличением скорости реакции, что в случае электрохимических процессов ведет к увеличению плотности тока. Между плотностью тока (i) и электрохимическим перенапряжением (Δφэл) существует взаимосвязь, выражаемая уравнением Тафеля
Δφэл = a + blgi,
где a и b – константы, определяемые опытным путем. Константа, а зависит от природы реакции, материала электрода, состава раствора и температуры. Константа b зависит от природы реакции и температуры. Численные значения констант уравнения Тафеля можно найти в справочных изданиях. Электрохимическое перенапряжение может быть снижено использованием соответствующих материалов для электродов, а также проведением процессов при повышенных температурах и концентрациях растворов. Использование электродов большой площади снижает плотность тока и также ведет к уменьшению перенапряжения.