Для фуллеренов можно выделить два основных типа реакций: с переносом электрона и присоединения.
Реакции с переносом электрона.
Сравнение химического поведения фуллерена с другими молекулами показывает, что С 60 обычно ведет себя как электронодефицитный полиолефин, для которого делокализация электронов не имеет такого же значения, как для бензола. Принимая от одного до шести электронов, [60]фуллерен превращается в анион, причем в качестве доноров электронов могут выступать электрический ток, щелочные или щелочноземельные металлы, комплексные соединения переходных металлов или органические молекулы-доноры.
Реакции присоединения.
Простейшие реакции данного класса сопровождаются разрывом двойных связей и присоединением двух функциональных групп. Соответственно для реакций гидрирования и галогенирования характерно образование соединений С 60 Х 2 n с четным количеством присоединенных атомов. Подобно алкенам, фуллерены легко образуют продукты циклоприсоединения. Например, в реакции Дильса–Альдера они, обладая электронодефицитным характером, выступают в качестве диенофилов, а в реакциях 1,3-диполярного циклоприсоединения – в качестве диполярофилов.
Первым изученным химическим свойством фуллерена было восстановление. Как только стала понятной электрофильная природа фуллерена, для получения фуллереновых солей были осуществлены различные реакции, например с активными металлами, органическими молекулами – донорами электронов, электрохимическое восстановление. Анион фуллерена оказался весьма активным участником многих реакций, подвергаясь электрофильным атакам, что открыло синтетические подходы к органической химии фуллерена. Электрохимическое восстановление фуллерена[60] может быть осуществлено в бензонитрильном растворе перхлората тетра н -бутиламмония (ТБАClO 4), который достаточно полярен для растворения образующегося по приведенной схеме темно-красного дианиона:
 |
 |
Обработка полученного раствора иодистым метилом приводит к образованию темно-коричневого раствора диметилфуллерена С60 (СН 3) 2 (смесь продуктов 1,2- и 1,4-присоединения в соотношении 3:2):
Образование комплексов с переходными металлами.
Высокое сродство молекул С 60 и С 70 к электрону проявляется в склонности к образованию комплексов с переходными металлами. Изучение кристаллической структуры получающихся соединений привело к выводу, что процесс комплексообразования переходных металлов с фуллереновым ядром по сути своей такой же, как и хорошо известная реакция комплексообразования с электронодефицитными алкенами. Так, при взаимодействии ди(трифенилфосфин)-платины с этиленом (представляющим собой плоскую молекулу) образуется комплекс, сокращенно обозначаемый (Ph 3 P) 2 Pt(η 2 -C 2 H 4), в котором атомы водорода в молекуле этилена более не лежат в плоскости, а отклонены на угол θ, что является мерой прочности донорно-акцепторных связей. Такое изменение конфигурации заместителей усиливается при наличии в молекуле этилена более электроноакцепторных заместителей, чем водород. С раствором [60]фуллерена в толуоле (Ph 3 P) 2 Pt(η 2 -C 2 H 4) образует окрашенный в изумруднозеленый цвет комплекс (Ph 3 P) 2 Pt(η 2 -C 60). (В формулах таких соединений цифра 2 указывает количество электронов, перемещенных от π - 
системы этилена-донора на вакантную орбиталь платины-акцептора.)
РЕАКЦИИ ПРИСОЕДИНЕНИЯ
Реакции циклоприсоединения
В реакциях циклоприсоединения активную роль всегда играют двойные связи шестичленного кольца, выступая в качестве как диенофилов, так и диполярофилов. Огромное число циклоаддуктов, которые при этом можно получить, способствовало повышению интереса исследователей к химии фуллеренов. Эти реакции стали мощным инструментом, позволяющим вводить в С 60 практически любые функциональные группы, получая вещества, обладающие многими полезными свойствами. Окисление и реакции с электрофильными агентами.
Хотя восстановление фуллеренов кажется значительно более легким, учитывая склонность к принятию электронов (максимально может быть принято шесть электронов), многие реакции окисления, протекающие без разрыва фуллереновой сферы и изменения общего характера связей, оказываются вполне осуществимыми.
 |
Продукты окисления фуллеренов С 70 О n и С 60 О n могут быть найдены в составе фуллеренового экстракта, полученного при испарении графита в вольтовой дуге. Образование этих оксидов происходит при совместном действии кислорода и света. Так, в склянке, в которой в течение полугода на солнечном свету хранили раствор С 60 в толуоле, на стенках образовался коричневый налет, представляющий собой плохо растворимый в толуоле оксид С 60 О:
Значительно больший интерес представляет галогенирование фуллеренов. Для фуллеренов относительно легко осуществляются реакции хлорирования и бромирования. Так, например, описан хлорид С 60 Cl 6, бромиды C 60 Br 8, C 60 Br 24, причем последняя молекула является высокосимметричной. Все они легко теряют галоген при нагревании до 150 ° С.
Полихлорирование С 60 проводят пропусканием слабого тока хлора в горячей стеклянной трубке при 250–400 ° С или при обработке твердого С 60 жидким хлором при − 35 ° С.
 |
Индивидуальный чистый изомер C 60 Cl 6 был получен реакцией С 60 с избытком ICl в бензоле или толуоле при комнатной температуре:
Обработка С 60 жидким бромом дает симметричное желто-оранжевое кристаллическое вещество состава C 60 Br 24. При фторировании фуллеренов обнаружен полный набор соединений C 60 F n, где n принимает четные значения вплоть до 60. Фторпроизводные с n от 50 до 60 называются перфторидами и обнаружены масс-спектрометрическим методом в чрезвычайно малых концентрациях. Синтез стехиометрических фторпроизводных [60]фуллерена удалось осуществить только в трех случаях: C 60 F 18 при фторировании K 2 PtF 6, C 60 F 36 при фторировании MnF 3 и C 60 F 48 при фторировании молекулярным фтором. Фторирование фуллерена обработкой его раствора в хлористом метилене XeF 2 или твердого С 60 газообразным F 2 при низком давлении приводит к полифторфуллеренам C 60 F n (c n = 15–20). Нельзя не упомянуть, говоря о взаимодействии фуллерена с фтором, о явлении гиперфторирования, то есть о продуктах состава C 60 F 2 n c n > 30. Впервые такие вещества были получены Тюинманном в 1993 году при обработке под действием ультрафиолетового облучения. Дальнейшие исследования показали, что часть углерод-углеродных связей в продуктах оказывается разрушенной, а реакция протекает по радикальному механизму. Если растворимость самого фуллерена C 60 в растворителях неароматического характера близка к нулю, то его фториды достаточно хорошо растворимы в гексане, хлороформе, ацетоне и находят применение как промежуточные продукты в реакциях органического синтеза. При гидрировании фуллеренов были получены соединения C 60 Н 18, C 60 Н 36. Таким образом, при размещении на углеродной сфере малых функциональных групп и при отсутствии стерических затруднений наиболее стабильными оказываются структуры с 18 и 36 присоединенными группами.
2.2 
Структурное разнообразие в химии фуллеренов
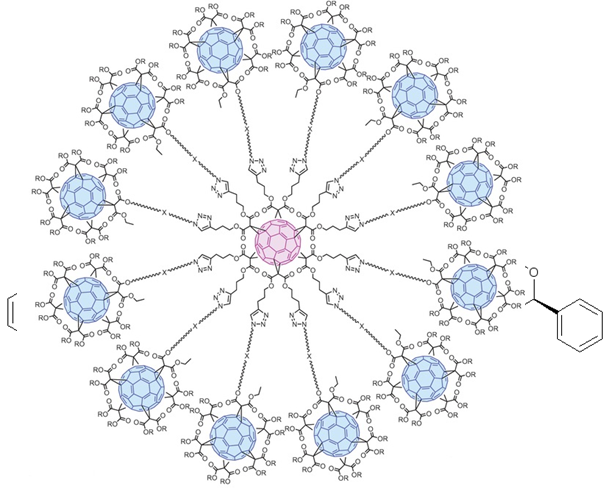
Будучи электронодефицитным полиеном, фуллерен легко вступает в реакции нуклеофильного, радикального и циклоприсоединения. Все эти виды химических процессов в настоящее время используются для целенаправленной модификации ядра С60 с целью получения новых соединений с прогнозируемыми биологическими, фотоэлектрическими, электрофизическими, каталитическими, адсорбционными и другими полезными свойствами. Примеры некоторых таких структур:

 |