Альдегиды классифицируются по нескольким признакам:
1. В зависимости от насыщенности углеводородного заместителя:
- предельные (насыщенные) альдегиды (ацетальдегид);
- непредельные (ненасыщенные) альдегиды (акролеин);
- ароматические альдегиды (бензальдегид).
2. В зависимости от числа карбонильных групп:
- альдегиды с одной карбонильной группой (формальдегид);
- диальдегиды (глиоксаль);
- многоатомные альдегиды.
НОМЕНКЛАТУРА И ИЗОМЕРИЯ АЛЬДЕГИДОВ
В соответствии с международной (систематической) номенклатурой ИЮПАК названия простых альдегидов образуются от названий соответствующих алканов с добавлением суффикса -аль (для диальдегидов — суффикса -диаль). Помимо систематической номенклатуры, для обозначения альдегидов широко используются тривиальные названия:
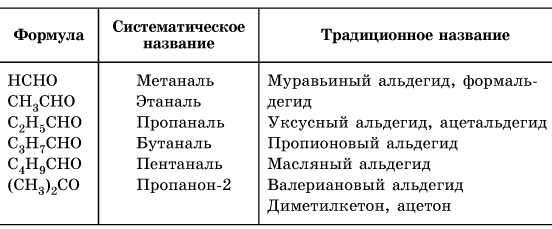
При составлении названия альдегидов по систематической номенклатуре нужно помнить ряд правил:
1. Если альдегидная группа в соединении одна, то она всегда занимает крайнее положение, и поэтому в названии альдегида номер при альдегидной группе, как правило, не ставят.
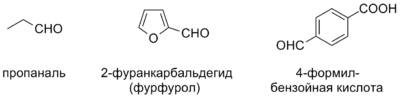
2. Если карбонильная группа не входит в родоначальную структуру (например, если родоначальной структурой является циклический углеводород или гетероцикл), то к названию добавляется суффикс -карбальдегид.
3. Если в соединении альдегидная группа не является старшей, то в таких случаях её обозначают используя приставку формил-, указывая её положение:
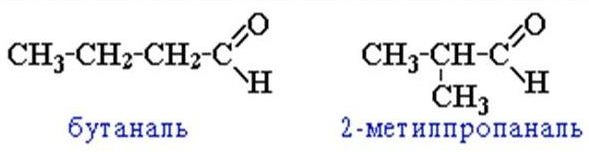
Для альдегидов характерна следующие виды изомерии:
- изомерия углеродного скелета (начиная с С4)
- межклассовая изомерия (с кетонами)
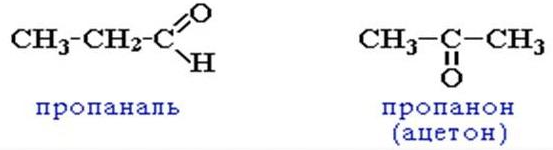
ФИЗИЧЕСКИЕ СВОЙСТВА АЛЬДЕГИДОВ
В альдегидах водородные связи более слабые, чем в спиртах. Сравним полярность связей -O-H и -С-H, частичный положительный заряд на водороде гидроксильной группы больше, чем на водороде карбонильной группы, так как разница в электроотрицательности между кислородом и водородом больше, чем между углеродом и водородом. Поэтому из всех альдегидов с одной карбонильной группой только формальдегид представляет собой газообразное при комнатной температуре вещество. Альдегиды С2 - С12 — жидкости, а альдегиды нормального строения с более длинным неразветвлённым углеродным скелетом, являются твёрдыми веществами. Температуры кипения альдегидов с неразветвлённым строением углеродной цепи выше, чем у их изомеров. Они кипят при более низких температурах, чем спирты с тем же числом углеродных атомов, например, пропионовый альдегид кипит при 48,80C, а пропанол-1 при 97,80C.
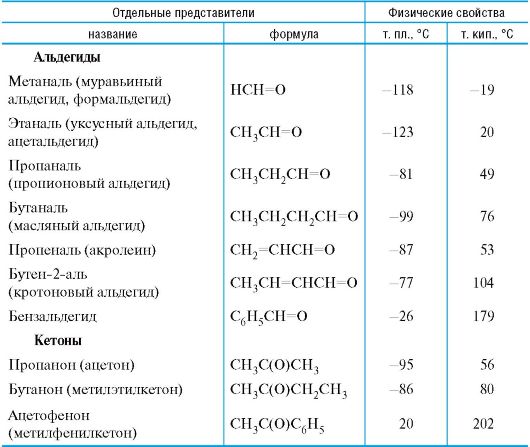
Формальдегид и ацетальдегид практически неограниченно смешиваются с водой, однако, с ростом длины углеродного скелета, растворимость альдегидов в воде сильно уменьшается, например, растворимость гексаналя при 200C составляет лишь 0,6 % по массе. Алифатические альдегиды растворимы в спиртах, простых эфирах и других распространённых органических растворителях.
КЕТОНЫ
Слово кетон произошло от старого немецкого слова Aketon (ацетон). Придумал его в 1848 году немецкий химик Леопольд Гмелин (1788—1853), однако первый кетон - ацетон был открыт Робертом Бойлем еще в 1661 году при нагревании ацетата кальция (ацетон происходит от лат. acetum — уксус):
Ca(CH3COO)2⟶CH3−C(O)−CH3+CaCO3
Определение
Кетоны — органические вещества, в молекулах которых карбонильная группа связана с двумя углеводородными радикалами.
Общая формула кетонов: R1−C(O)−R2.
Карбонильная группа -С(О)- в кетонах также часто называется кето-группой.