Пример 1.
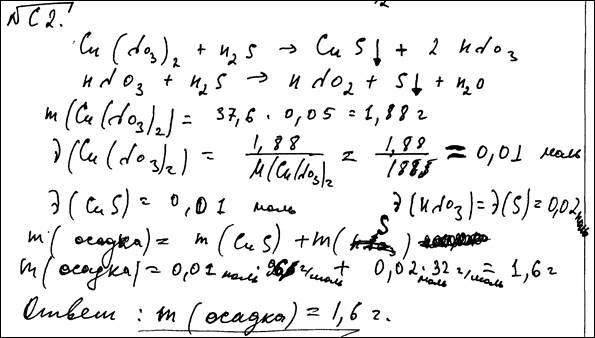
Представленное решение - наглядный пример того, насколько существенно может отличаться решение, предлагаемое учеником, от решения, представленного в эталоне ответа. В целом ошибок в решении задания учащийся не допустил. Все расчеты проведены верно. Основания для снижения оценки нет. (3 балла)
Пример 2.

В данном примере задача решена способом, отличающимся от представленного в эталоне ответа: решение выполнено с помощью пропорции. Все необходимые вспомогательные вычисления выполнены правильно. (3 балла)
Пример 3.

При решении задачи учащийся также составил пропорцию. Однако уже на первом этапе решения неверно определил массу растворенного вещества, содержащегося в растворе.
Именно эта ошибка привела в итоге к получению неверного ответа. Признать данную ошибку учащегося только как ошибку в вычислениях было бы неверным, т.к. она допущена из-за неполного владения им понятием «массовая доля растворенного вещества». Есть ошибки и в расчетах относительных молекулярных масс веществ.
В то же время итоговая пропорция составлена и решена (с учетом уже сделанной ранее ошибки) верно.
(1 балл)
Пример 4.

В представленном решении ошибки нет. Неверно обозначенные молярные массы веществ, участвующих в реакции, не должны становиться основанием для снижения оценки, т.к. эти записи являются вспомогательными и на ход решения задания влияния не оказывают. (3 балла)
Пример 5.

В данном решении задания ошибка допущена при составлении формулы нитрата меди(II), что привело к неверному составлению уравнения реакции и неверному расчету относительной молекулярной массы данного вещества, а так как эта величина используется и на завершающем этапе расчетов, то в результате (в итоговом значении ответа) также допущена ошибка. Таким образом, верно выполненным является только второй элемент решения. (1 балл)
Задание С3
Для проведения эксперимента предложены следующие реактивы: оксид магния и растворы сульфата магния, хлорида бария, хлорида меди(II), серной кислоты и соляной кислоты. Вам также предоставлен комплект лабораторного оборудования, необходимого для проведения химических реакций.
| 22 |
Используя необходимые вещества только из этого списка, получите в результате проведения двух последовательных реакций раствор хлорида магния. Составьте схему превращений, в результате которой можно получить указанное вещество. Запишите уравнения двух реакций. Для второй реакции составьте сокращённое ионное уравнение.
| Содержание верного ответа и указания по оцениванию(допускаются иные формулировки ответа, не искажающие его смысла) | Баллы |
| 1) Составлена схема превращений, в результате которой можно получить хлорид магния: MgO или H2SO4 → MgSO4 → MgCl2 Составлены уравнения двух проведённых реакций: 2) MgO + H2SO4 = MgSO4 + Н2О 3) MgSO4 + BaCl2 = BaSO4↓ + MgCl2 Составлено сокращённое ионное уравнение второй реакции: 4) Ba2+ + SO42- = BaSO4↓ | |
| Ответ правильный и полный, содержит все названные элементы | |
| Правильно записаны три элемента ответа | |
| Правильно записаны два элемента ответа | |
| Правильно записан один элемент ответа | |
| Все элементы ответа записаны неверно | |
| Максимальный балл | 4 |
| 23 |
Подготовьте лабораторное оборудование, необходимое для проведения эксперимента. Проведите реакции в соответствии с составленной схемой превращений. Опишите изменения, происходящие с веществами в ходе проведённых реакций. Сделайте вывод о химических свойствах веществ (кислотно-оснόвных) участвующих в реакции и классификационных признаках реакций.
| Содержание верного ответа и указания по оцениванию(допускаются иные формулировки ответа, не искажающие его смысла) | Баллы | |
| К1 | Проведены реакции в соответствии с составленной схемой, и описаны изменения, происходящие с веществами в ходе проведения реакций: 1) для первой реакции: растворение твёрдого вещества, и образование прозрачного раствора; 2) для второй реакции: выпадение белого осадка; 3) сформулирован вывод о свойствах веществ и классификационных признаках проведённых реакций: в основе проведённого эксперимента лежит реакция обмена между основным оксидом и кислотой, протекающая за счёт выделения воды, а также реакция ионного обмена между двумя солями, протекающая за счёт образования осадка. | |
| Ответ правильный и полный, содержит все названные элементы | ||
| Правильно записаны два элемента ответа | ||
| Правильно записан один элемент ответа | ||
| Все элементы ответа записаны неверно | ||
| К2 | Оценка техники выполнения химического эксперимента: · соблюдение общепринятых правил при отборе нужного количества реактива; · соблюдение правил безопасного обращения с веществами и оборудованием при проведении химических реакций | |
| При проведении эксперимента полностью соблюдались все правила отбора реактивов и проведения химических реакций | ||
| При проведении эксперимента были нарушены требования правил отбора реактивов или проведения химических реакций | ||
| При проведении эксперимента были нарушены правила отбора реактивов и проведения химических реакций |
Пример 1.

В представленном решении учащийся верно выполнил все элементы содержания, кроме первого – не составлена схема превращения (необходимость этого шага прописана в условии задания). Верно записаны два молекулярных и одно сокращённое ионное уравнение, верно указаны признаки протекания обеих химических реакций, а также сформулирован вывод о том, что это реакция ионного обмена, а из предыдущих записей очевидно, что реакция протекает за счёт растворения осадка. Такой вывод можно принять.
В данном случае нет возможности определить правильность проведения химического эксперимента, поэтому критерий 2 не оценивается.
Итоговая отметка за запись задания – 6 баллов.
Пример 2.

В предложенном решении учащийся верно записал общую схему процесса, два молекулярных уравнения реакции и сокращённое ионное уравнение.
В качестве верных можно засчитать и признаки протекания обеих химических реакций (хотя в первом случае есть указание на изменение цвета, которое не происходит).
Верным можно признать и вывод, который учащийся делает по второму уравнению реакции – реакция ионного обмена (качественная), сопровождающаяся выпадением осадка. Как и в предыдущем примере, отсутствует возможность оценивания критерия 2.
Таким образом, за запись решения заданий учащийся может получить 7 баллов.
Пример 3.


В данном решении предложена другая схема получения хлорида магния, но она тоже верная. Однако учащийся не оформил её виде отдельной записи, хотя об этом говорится в условии задания, а следовательно, балл за этот элемент ответа он получить не может.
Два молекулярных и одно сокращённое ионное уравнения реакций записаны верно. Другие элементы ответа отсутствуют
Итоговая отметка за задание(я) – 3 балла.