4.1. Материалы для практических занятий по оценке выполнения заданий разных типов (по линиям заданий)
Задание 20(С1)
Используя метод электронного баланса, составьте уравнение реакции
S + Cl2 + H2O → H2SO4 + HCl
Определите окислитель и восстановитель.
| Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) | Баллы | ||
Элементы ответа:
1) Составлен электронный баланс:
2) Указано, что сера в степени окисления 0 является восстановителем, а хлор в степени окисления 0 (или Cl2) – окислителем; 3) Составлено уравнение реакции: S + 3Cl2 + 4H2O = H2SO4 + 6HCl | |||
| Ответ правильный и полный, содержит все названные выше элементы | |||
| В ответе допущена ошибка только в одном из элементов | |||
| В ответе допущены ошибки в двух элементах | |||
| Все элементы ответа записаны неверно | |||
| Максимальный балл | 3 |
С1)

С1)
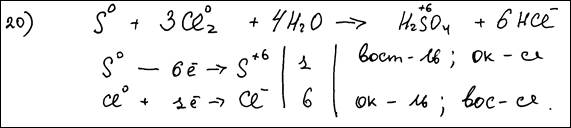
С1)

С1)
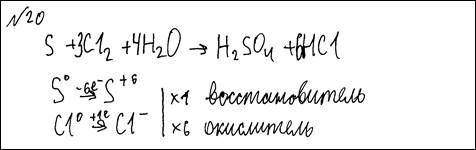
С1)

Задание 21(С2)
1 – 21 (С2) А.
К 104 г раствора с массовой долей хлорида бария 9% добавили избыток раствора фосфорной кислоты. Вычислите массу образовавшегося осадка.
| ||
| Критерии оценивания | Баллы | |
| Ответ правильный и полный, включает все названные элементы. | ||
| Правильно записаны 1-й и 2-й элементы из названных выше. | ||
| Правильно записан один из названных выше элементов (1‑й или 2‑й). | ||
| Все элементы ответа записаны неверно. | ||
| Максимальный балл |
С2) - 1А

С2) - 2А

С2) - 3А

4 – 21 (С2) Б. К 296 г раствора с массовой долей нитрата магния 6% добавили избыток раствора фосфорной кислоты. Вычислите массу образовавшегося осадка.
| ||
| Критерии оценивания | Баллы | |
| Ответ правильный и полный, включает все названные элементы. | ||
| Правильно записаны 1-й и 2-й элементы из названных выше. | ||
| Правильно записан один из названных выше элементов (1‑й или 2‑й). | ||
| Все элементы ответа записаны неверно. | ||
| Максимальный балл |
С2) - 4Б

5 – 21 (С2) - В.
К раствору сульфита натрия массой 252 г и массовой долей 5% добавили избыток раствора соляной кислоты. Вычислите объем (н.у.) выделившегося газа.
| ||
| Критерии оценивания | Баллы | |
| Ответ правильный и полный, включает все названные элементы. | ||
| Правильно записаны 1-й и 2-й элементы из названных выше. | ||
| Правильно записан один из названных выше элементов (1‑й или 2‑й). | ||
| Все элементы ответа записаны неверно. | ||
| Максимальный балл |
С2) -5В

С3)
Для проведения эксперимента предложены следующие реактивы: медь, оксид меди(II) и растворы гидроксида натрия, сульфата железа(II), пероксида водорода, серной кислоты. Вам также предоставлен комплект лабораторного оборудования, необходимого для проведения химических реакций.
| 22 |
Используя необходимые вещества только из этого списка, получите в результате проведения двух последовательных реакций гидроксид меди(II).
Составьте схему превращений, в результате которых можно получить указанное вещество. Запишите уравнения двух реакций. Для второй реакции составьте сокращённое ионное уравнение.
| Содержание верного ответа и указания по оцениванию(допускаются иные формулировки ответа, не искажающие его смысла) | Баллы |
| Составлена схема превращений, в результате которой можно получить гидроксид меди(II): 1) CuO → CuSO4→ Cu(OH)2 Составлены уравнения двух проведённых реакций: 2) CuO + H2SO4 = CuSO4 + H2O 3) CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4 Составлено сокращённое ионное уравнение второй реакции: 4) Cu2+ + 2OH– = Cu(OH)2 | |
| Ответ правильный и полный, содержит все названные элементы | |
| Правильно записаны три элемента ответа | |
| Правильно записаны два элемента ответа | |
| Правильно записан один элемент ответа | |
| Все элементы ответа записаны неверно | |
| Максимальный балл | 4 |
С3)
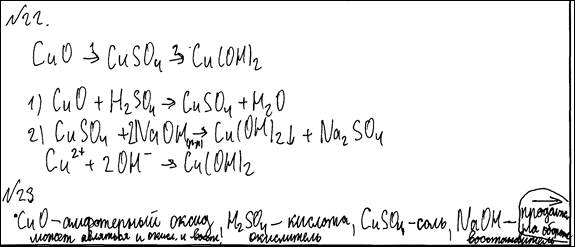

С3)
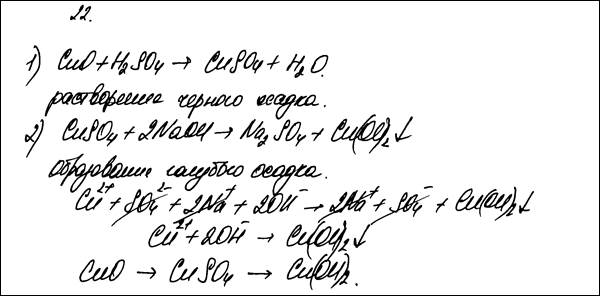
С3)
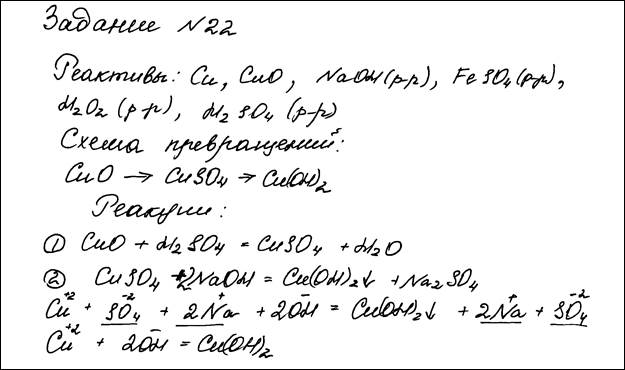
С3)

С3)

| 23 |
Подготовьте лабораторное оборудование, необходимое для проведения эксперимента. Проведите реакции в соответствии с составленной схемой превращений. Сделайте вывод о химических свойствах веществ (кислотно-оснόвных, окислительно-восстановительных), участвующих в реакции и классификационных признаках реакций.
| Содержание верного ответа и указания по оцениванию(допускаются иные формулировки ответа, не искажающие его смысла) | Баллы | |
| К1 | Проведены реакции в соответствии с составленной схемой, и описаны изменения, происходящие с веществами в ходе проведения реакций: 1) для первой реакции: растворение чёрного порошка оксида меди(II) и появление голубой окраски раствора; 2) для второй реакции: выделение голубого осадка гидроксида меди(II); 3) сформулирован вывод о свойствах веществ и классификационных признаках проведённых реакций: в основе проведённого эксперимента лежит реакция оснόвного оксида с раствором кислоты с образованием соли и воды; а также ионного обмена между солью и щёлочью, протекающая за счёт выпадения осадка | |
| Ответ правильный и полный, содержит все названные элементы | ||
| Правильно записаны два элемента ответа | ||
| Правильно записан один элемент ответа | ||
| Все элементы ответа записаны неверно | ||
| К2 | Оценка техники выполнения химического эксперимента: · соблюдение общепринятых правил при отборе нужного количества реактива; · соблюдение правил безопасного обращения с веществами и оборудованием при проведении химических реакций | |
| При проведении эксперимента полностью соблюдались все правила отбора реактивов и проведения химических реакций | ||
| При проведении эксперимента были нарушены требования правил отбора реактивов или проведения химических реакций | ||
| При проведении эксперимента были нарушены правила отбора реактивов и проведения химических реакций |