Раздел II. Классы органических соединений.
Тема 2.6. Спирты. Фенолы.
Урок: 2.6.7-8. Химические свойства и получение фенолов. Решение задач на вывод формул кислородсодержащих соединений.
План: 1. Химические свойства фенола.
Способы получения фенола.
Применение фенола.
Решение задач на вывод молекулярной формулы кислородсодержащего органического соединения.
Химические свойства фенола.
Наличие в молекуле фенола как гидроксильной группы, так и бензольного кольца в углеводородном радикале фениле обусловливает его химические свойства.
I. Реакции с участием гидроксильной группы.
Кислотные свойства
1) Диссоциация, в водных растворах с образованием фенолят-ионов и ионов водорода.
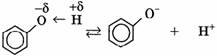
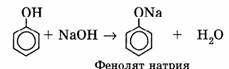
2) Взаимодействие со щелочами с образованием фенолятов (отличие от спиртов):.
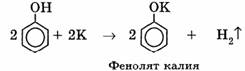
3) Взаимодействие с активными металлами с образованием фенолятов (сходство со спиртами):
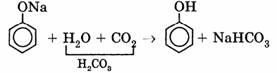
Образующиеся в результате реакций 2) и 3) феноляты легко разлагаются при действии кислот. Даже такая слабая кислота, как угольная, вытесняет фенол из фенолятов (следовательно, фенол — еще более слабая кислота, чем угольная):
Феноляты используются в качестве исходных веществ для получения простых и сложных эфиров фенола:
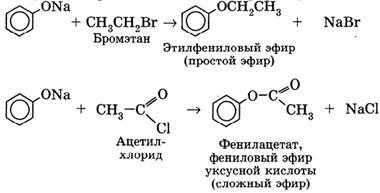
II. Реакции с участием бензольного кольца.
Реакции замещения
Реакции замещения в бензольном кольце фенолов протекают легче, чем у бензола, и в более мягких условиях.
1) Галогенирование:
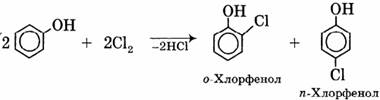
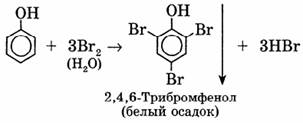
Особенно легко происходит бромирование в водных растворах, при этом сразу образуется 2,4,6-трибромфенол:
2) Нитрование:
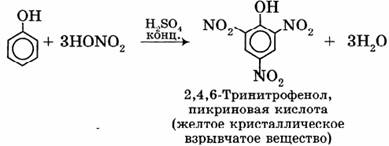
3) Сульфирование:
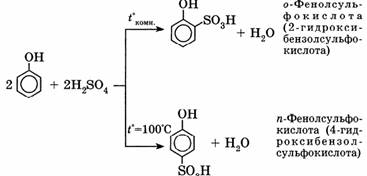
Соотношение о- и п-изомеров определяется температурой реакции: при комнатной температуре в основном образуется о-фенолсульфокислота, при t°= 100°С — параизомер.
Реакции присоединения
1) Гидрирование:
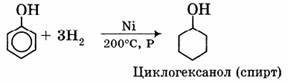
III. Качественные реакции на фенолы.
В водных растворах одноатомные фенолы взаимодействуют с хлоридом железа (III) FeCl3 с образованием комплексных фенолятов, которые имеют фиолетовую окраску; окраска исчезает после прибавления сильной кислоты.
Способы получения фенола.
Из каменноугольной смолы.
Каменноугольную смолу, содержащую в качестве одного из компонентов фенол, обрабатывают вначале раствором щелочи (образуются феноляты), а затем — кислотой:
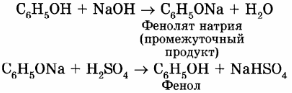
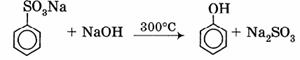
2. Сплавление солей аренсульфокислот со щелочью:
3. Взаимодействие галогенпроизводных ароматических У В со щелочами или с водяным паром:
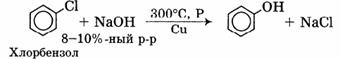
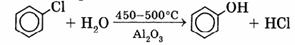
Кумольный способ.
В качестве исходного сырья используют бензол и пропилен, из которых получают изопропилбензол (кумол), подвергающийся дальнейшим превращениям:
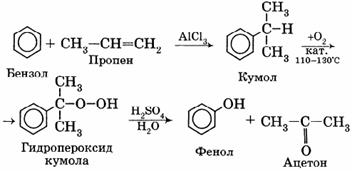
В результате этих процессов получают два ценных продукта — фенол и ацетон.
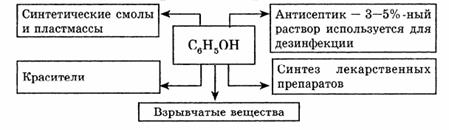
Применение фенола.
Решение задач на вывод молекулярной формулы кислородсодержащего органического соединения.
Задача 1. Найдите молекулярную формулу кислородсодержащего органического вещества, плотность которого равна 2,68 г/л, если при сгорании 1,2 г паров его образуется 1,344 л (н.у.) оксида углерода (IV) и 1,44 г воды. Запишите уравнение реакции горения этого вещества.
| Дано: | Решение: |
| m(СхНуОz) = 1.2г | (Общим для решения различными способами данной задачи |
| р(СхНуОz) = 2,68 г/л | является нахождение М (СхНуОz) и оформление условной |
| V(СО2) = 1,344л | записи схемы реакции горения). |
| m(Н2О) = 1,44 г | |
| Найти: СхНуОz | 1) М (СхНуОz)= р*Vm = 2,68 г/л * 22,4л/моль = 60 г/моль |
| М (СхНуОz) = 60 г/моль | |
| 2) СхНуОz + О2 = СО2 + Н2О |
1 способ (наиболее рациональный)
n(СхНуОz) – 1,2 г / 60 г/моль = 0,02 моль
n (СО2) = 1,344л / 22,4 л/моль = 0,06 моль
n (Н2О) = 1,44г/ 18 г/моль = 0,08 моль
х:у:z= n (СхНуОz): n (СО2): n (Н2О) = 0,02: 0,06: 0,08 = 2:6:8
Следовательно, 2С3Н8О + 9О2 = 6СО2 + 8Н2О
М(С3Н8О) = 60
2 способ.
Находим количество вещества СО2 и Н2О, а затем по этим данным вычисляют количество вещества химических элементов углерода и водорода:
1.n(СО2) = 1,344/22,4 = 0,06 моль
n(Н2О)= 1,44/18 = 0,08 моль
2. М(С) = 12 г/моль
М(Н) = 1 г/моль, откуда следует
m(С) = 12* 0,06 = 0,72г
m(Н) = 0,08г
3. m(О)=m(СхНуОz) – m(С) – m(Н)
m(О) = 1,2 – 0,72 – 0,08 = 0,4г
n(О) = 0,025 моль
4. х:у:z = 0,06: 0,08: 0,02 = 3: 8: 1, следует формула С3Н8О
3 способ
Если точно известно, что данное органическое вещество спирт, то решение может быть сведено к нахождению "n" в общей формуле СnН2n+1ОН
М(СnН2n+1ОН) = 60г/моль (см. 1 способ)
Далее составим уравнение и вычислим "n"
12n + 2n + 1 + 16 + 1 = 60
14n=42
n = 3, следует С3Н8О
Проверка: М(С3Н8О) = 60 г/моль
Решение задачи сводится к нахождению углеводородного радикала R-ОН, для этого 60 – 17 = 43, следовательно 12n+2n+1=43
n = 3; (С3Н7ОН)
Задача 2. Установите простейшую формулу вещества, содержащего 37,50 % углерода, 12,50 % водорода и 50,00 % кислорода (по массе).
Задача 3.
В результате сжигания 1,50 г органического вещества получено 2,20 г углекислого газа и 0,90 г воды. Молярная масса вещества равна 60 г/моль. Установите формулу вещества.