Методы измерения электропроводности растворов, мостик Кольрауша
При пропускании постоянного тока через раствор будут проходить следующие процессы. На первой стадии катионы направятся к катоду, а анионы – к аноду, т. е. начнется пространственное разделение зарядов, появится наведенная ЭДС и свойства раствора изменятся. Если постоянный ток пропускать дальше, то ионы достигнут поверхности электрода и там пойдут окислительно-восстановительные реакции, называемые электролизом. Рассмотрим это на примере раствора ZnSO4. На катоде восстанавливается металл: Zn2+ + 2e– Zn0 и он покрывается металлической пленкой. Это способ нанесения гальванических покрытий, он применяется при хромировании, оцинковке и др. На аноде будут выделяться газы: SO42– – 2e– SO2 + 1⁄2 O2. Свойства раствора изменятся уже необратимо. Этих процессов при измерении электропроводности следует избегать.
Поэтому для измерения электропроводности растворов применяют переменный ток звуковой частоты (1 МГц и выше). Схема установки для измерения электропроводности растворов приведена на рис. 4.3. Называется эта схема мостом Кольрауша. Основная идея применения переменного тока заключается в том, что в этом случае времени на формирование новой фазы окажется недостаточно, состав раствора не изменится и электролиза не будет.
Здесь Х – измерительная ячейка, т. е. сосуд, в котором измеряется сопротивление (электропроводность) раствора, М – магазин сопротивлений, АВ – проволочный (струнный) реохорд длиной L, И – индикатор. Перемещая движок С вдоль реохорда, можно непрерывно изменять
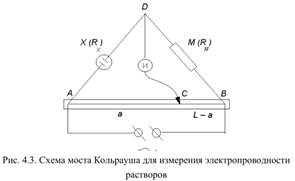 |
соотношение сопротивлений RAC и RBC. Отношение частей сопротивлений реохорда равно отношению длин его плеч, т. е. RAC /RBC = a/(L–a)
Индикатор служит для фиксирования момента уравновешивания моста, когда в цепи DC отсутствует ток. Измерительный мост Кольрауша состоит из четырех замкнутых ветвей сопротивлений RX, RM, RAC и RBC. Источник питания подключен к клеммам А и В. В каждой из ветвей моста протекает ток, величина которого зависит от сопротивления. При постоянном сопротивлении раствора, помещенного в кондуктометрическую ячейку, подбирают три других сопротивления таким образом, чтобы ток в цепи CD упал до нуля. Отсутствие тока будет при равенстве потенциалов в точках D и С. Это означает, что должны быть равными падения напряжения в ветвях АD и АС и, соответственно, ВD и ВС. При отсутствии тока в цепи DС
RX / RM = RAC / RBC; откуда, с учетом формулы для RAC / RBC следует RX = RM a / (L – a)
Или электропроводность 1 / RX = (L – a) / (RM a)
Электролиз растворов электролитов, его применение. Гальванические покрытия
Раствор обладает ионной проводимостью и поэтому относится к проводникам второго рода.
Способность раствора проводить электрический ток характеризуют удельной и эквивалентной электропроводностью. Удельная электропроводность (χ) – это электропроводность 1 м3 раствора, помещенного между двумя параллельными электродами площадью 1 м2 на расстоянии 1 м. Эквивалентная электропроводность (λ) – это электропроводность раствора, содержащего одну молярную массу эквивалента (1 кг-экв) и помещенного между одинаковыми электродами, расположенными на расстоянии 1 м. Удельная электропроводность пропорциональна силе токов, создаваемых при данных условиях движением катионов (iK) и анионов (iA). Эти токи, в свою очередь, пропорциональны скорости ионов (UK и UA): iK = α*с*F*UK и iА = α*с*F*UА. Тогда
χ = α*с*F* (UK + UA) = α*с*(lК + lА),
где lК и lА – подвижности катиона и аниона. Подвижность иона l= FU пропорциональна скорости его движения и зависит от природы иона, а также от температуры и концентрации раствора. В бесконечно разбавленном растворе ионы не взаимодействуют и подвижность становится величиной постоянной, зависящей только от природы иона и температуры. В стандартных условиях подвижность – табличная величина. Она измеряется в Ом-1.м2/моль или См.м2/моль, где См=Ом-1 - Сименс.
Основная часть ионов имеет близкие значения l, только ионы водорода (точнее – ион гидроксония Н3О+) и гидроксила обладают аномально высокой подвижностью. Связано это с тем, что все остальные ионы перемещаются путем обычной миграции, тогда как эти два иона – с помощью эстафетного механизма
Н3О+ + Н2О= Н2О + Н3О+ ОН– + Н2О= Н2О + ОН–
Такой механизм миграции оказывается гораздо более эффективным, так как ионы перемещаются не сами по себе вместе с гидратной оболочкой, а передают по эстафете лишь свой заряд. Эстафетный механизм движения связан с разрывом связей. Ковалентная связь в молекуле воды много прочнее связи в ионе гидроксония, поэтому подвижность гидроксила существенно ниже. 
Как для сильного, так и для слабого электролита в разбавленных растворах электропроводность с ростом концентрации повышается. В разбавленных растворах lК и lА от концентрации не зависит, – постоянна и рост электропроводности обусловлен только ростом концентрации ионов. Для сильного электролита α= 1 при всех концентрациях раствора. Для него при более высоких c ионов становится в растворе много, их концентрация возрастает и они начинают взаимодействовать, образовывать, как говорят, ионную атмосферу. Электростатическое притяжение ионов приводит к тому, что уменьшается их подвижность. Причем, уменьшение подвижности с ростом концентрации происходит достаточно круто, что приводит к резкому падению электропроводности раствора сильного электролита при больших концентрациях.
Для слабого электролита повышение концентрации приводит к ослаблению зависимости χ от c. При максимальных концентрациях эта зависимость исчезает, значение χ практически достигает предела. Ионов в концентрированных слабых электролитах мало, электростатическое взаимодействие несущественно, подвижность постоянна. Но здесь с ростом c уменьшается степень диссоциации α = (КД / с)1/2, что и приводит к такой зависимости χ от c. 
Эквивалентная электропроводность связана с удельной: λ = χ / c. Ее зависимость от концентрации отражает изменение физических свойств раствора (рис. 4.2) в чистом виде, так как для эквивалентной электропроводности нет влияния самой концентрации. Зависимость λ(c) удобнее представлять как функцию степени разбавления V = 1/c (V – обратная концентрации величина)