Электродом называют электронопроводящую фазу (металл или полупроводник), контактирующую с ионным проводником (электролитом). Электродные процессы представляют собой окислительно- восстановительные реакции, протекающие на электродах. В ходе этих реакций происходит переход электрических зарядов из одной фазы в другую, в результате чего на поверхности твердой фазы сосредоточиваются, например, отрицательные заряды, а в жидкой – положительные (или наоборот). В итоге на границе раздела фаз создается двойной электрический слой (ДЭС), которому соответствует определенный скачок потенциала. Электронопроводящая фаза (металл, уголь, графит и пр.), вместе с раствором или расплавом электролита образует полуэлемент. Соединяя два полуэлемента получают гальванический элемент. Как видно, в электрохимических цепях имеются твердые фазы (левый и правый электроды) и жидкие фазы (растворы, примыкающие к электродам). Могут быть также и газовые фазы, граничащие с раствором и электродами (по свойствам близкие к вакууму).
Рассмотрим причины возникновения заряда электродов. Поместим серебряную пластинку в раствор AgNO3. Ионы Ag+ находятся в этой системе в двух состояниях – сольватированные катионы в растворе и катионы в узлах кристаллической решетки металла. При соприкосновении раствора и металла между этими двумя состояниями начнется обмен катионами. Этот процесс пойдет до тех пор, пока в системе не установится равновесие, т. е. пока не уровняются химические потенциалы ионов серебра в двух фазах – металле и растворе. Направление процесса, т. е. куда преимущественно будут переходить катионы, определяется соотношением энергии сольватации (Uсол) и энергии решетки (Uреш). Если Uсол <Uреш (а для серебра это именно так), то катионам выгоднее сбросить гидратную оболочку и внедриться в металл. При этом затрачивается энергия на десольватацию, но выигрывается энергия решетки. Металл в этом случае будет заряжаться положительно, раствор – отрицательно. Положительно заряженная поверхность металла притягивает к себе анионы из раствора, на поверхности металла образуется скачок потенциала и формируется ДЭС (рис. 4.9). 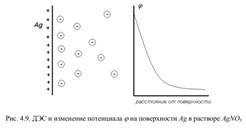
Для металлов, обладающих мягкой, пластичной решеткой часто возникает обратная ситуация, когда Uсол > Uреш. В этом случае катионам выгоднее покинуть металл и перейти в раствор. Тогда металл зарядится отрицательно, а раствор – положительно. К таким металлам относится,
например, Zn, погруженный в раствор ZnSO4.
Разность потенциалов между двумя точками определяется работой, которую необходимо совершить, чтобы перенести элементарную частицу электричества из одной точки в другую. Если обе точки находятся в одной и той же фазе, то работа переноса заряда будет электрической (она равна z F φ, где z – зарядкатиона,F–числоФарадея, –потенциал)и разность потенциалов между выбранными точками 1 – 2 можно измерить или вычислить. Если точки лежат в двух разных фазах, то перенос элементарной частицы электричества будет связан не только с электрической, но и с химической работой, поскольку химические потенциалы этой частицы в разных фазах неодинаковы. Тогда в условиях равновесия достигается равенство не чисто химических, а электрохимических потенциалов
μ 1 + z F φ 1 = μ 2 + z F φ 2,
Δφ = (μ 1 – μ 2) / z F φ
Для раствора φ = φ 0 + RT ln aК, где aК активность катиона в растворе.
где μ 1 и μ 2– значения химических потенциалов катиона в решетке и растворе. Отсюда можно рассчитать значение скачка потенциала на поверхности металла. Химический потенциал иона в кристаллической решетке – величина постоянная, и тогда выражение для потенциала электрода принимает вид
μ = μ 0 + (RT / z F) ln aК,
где μ 0 – стандартный электродный потенциал при aК = 1(является мерой индивидуального потенциала обратимого электрода (в равновесии) в стандартном состоянии, которое осуществляется в растворах при эффективной концентрации в 1 моль/кг и в газах при давлении в 1 атмосферу или 100 кПа (килопаскалей) измеряется в Вольтах). Это уравнение Нернста–Тюрина. В общем случае, когда в электрохимическом процессе есть окисленная и восстановленная форма какого-то соединения, уравнение Нернста–Тюрина принимает вид
φ = φ0 + (RT / z F) ln (aок / aвос).
Здесь aок и aвос – активности окисленной и восстановленной форм.