ГОсударственный медицинский университет г.семей
Методические рекомендации
Для самостоятельной работы студента (СРС)
Специальность: 5В130100 «Общая медицина»
Дисциплина: Химия
Кафедра: биохимии и химических дисциплин
Курс 1
Темы № 1-10
Составитель:
Ассоциированный профессор (доцент)
кафедры биохимии и химических дисциплин, к.х.н. Болысбекова С.М.
Семей – 2014
Утверждены на заседании кафедры
Протокол № 4 от 03. 11. 2014 г.
Зав.кафедрой биохимии
и химических дисциплин, д.м.н., профессор ________ Тапбергенов С.О.
Утверждены на заседании кафедры
Протокол № _____от "____" _________ 201_ г.
Внесены следующие изменения и дополнения (указать номер методической рекомендации)___________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
Заведующий кафедрой/ завуч ____________________(Ф.И.О., подпись)
ученая степень, ученое звание
Утверждены на заседании кафедры
Протокол № _____от "____" _________ 201_ г.
Внесены следующие изменения и дополнения (указать номер методической рекомендации)___________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
Заведующий кафедрой/ завуч ____________________(Ф.И.О., подпись)
ученая степень, ученое звание
Утверждены на заседании кафедры
Протокол № _____от "____" _________ 201_ г.
Внесены следующие изменения и дополнения (указать номер методической рекомендации)___________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
Заведующий кафедрой/ завуч ____________________(Ф.И.О., подпись)
ученая степень, ученое звание
Утверждены на заседании кафедры
Протокол № _____от "____" _________ 201_ г.
Внесены следующие изменения и дополнения (указать номер методической рекомендации)___________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
Заведующий кафедрой/ завуч ____________________(Ф.И.О., подпись)
ученая степень, ученое звание
1. Тема №1. Химическое равновесие. Роль катализа в жизнедеятельности организма.
2. Цель: Изучить основные понятия кинетики, влияния разных факторов на скорость химических реакции. Выяснить роль и особенности ферментативного катализа.
3. Задания:
1. Предмет и основные понятия химической кинетики.
2. Влияние на скорость химической реакции природы и концентрации реагирующих веществ.
3. Влияние давления на скорость химической реакции в газовой фазе.
- Молекулярность и порядок химической реакции.
- Влияние температуры на скорость химической реакции. Энергия активации и уравнение Аррениуса
- Влияние катализаторов на скорость химических реакции
- Роль катализа в жизнедеятельности живых организмов и особенности действия ферментов.
Задачи и упражнения:
1. Напишите математическое выражение закона действующих масс для следующей реакции: 2NO(г)+O2(г)=2NO2(г)
2. Схема реакции: 2NO(г)+O2(г)=2NO2(г), как изменится скорость химической реакции, если концентрацию оксида азота (II) увеличить в три раза?
3. Если концентрацию кислорода уменьшить в 2 раза, как изменится скорость химической реакции (2Н2+О2=2Н2О)?
4. Температурный коэффициент химической реакции равен 3. Если температуру увеличить на 300С, как изменится скорость химической реакции?
5. Напишите уравнение Аррениуса.
4. Форма выполнения:
Ответы на основные вопросы темы, выполнение контроля, решение задач и упражнений.
5. Критерии выполнения: Уметь правильно оформлять условие задачи, решать, знать формулировку и математическую запись основных формул кинетики.
6. Сроки сдачи: 3 неделя
7. Критерии оценки: по шкале оценки СРС (согласно критериям выполнения)
8. Литература:
Основная литература:
- Биоорганическая химия: учебник. Тюкавкина Н.А., Бауков Ю.И. 2014г.
- Сейтембетов Т.С. Химия: учебник - Алматы: ТОО"ЭВЕРО", 2010. - 284 с
- Болысбекова С. М. Химия биогенных элементов: учебное пособие - Семей, 2012. - 219 с.: ил
- Веренцова Л.Г. Неорганическая,физическая и коллоидная химия: учебное пособие - Алматы: Эверо, 2009. - 214 с.: ил.
- Физическая и коллоидная химия /Под ред.А.П.Беляева.- М.: ГЭОТАР МЕДиа, 2008
- Веренцева Л.Г. Неорганическая, физическая и коллоидная химия,(проверочные тесты) 2009
Дополнительная литература:
- Равич-Щербо М.И., Новиков В.В. Физическая и коллоидная химия. М. 2003.
- Слесарев В.И. Химия. Основы химии живого. С-Пб.: Химиздат, 2001
- Ершов Ю.А. Общая химия. Биофизическая химия. Химия биогенных элементов. М.: ВШ, 2003.
- Асанбаева Р.Д., Илиясова М.И. Теоретические основы строения и реакционной способности биологически важных органических соединений. Алматы, 2003.
- Руководство к лабораторным занятиям по биоорганической химии под ред. Н.А. Тюкавкиной. М., Дрофа,2003.
- Глинка Н.Л. Общая химия. М.,2003.
- Пономарев В.Д. Аналитическая химия ч.1,2 2003
Контроль
Студенту при защите СРС предлагается решить задачи, последняя цифра номера которых совпадает с последней цифрой номера, под которым студент записан в журнале.
- Написать математическое выражение для скорости химической реакций:
1.0. H2(г) + Cl2(г) → 2HCl(г)
1.1. 2NO(г) + O2(г) → 2NO2(г)
1.2. CaO(к) + СО2(г) → СаСО3(к)
1.3. 4NH3(г) + 3O2(г) → 2N2(г) + 6H2O(г)
1.4. FeO(к) + Н2(г) → Fe(к) + H2O(ж)
1.5. Zn(к) + H2SO4(ж) → ZnSO4(к) + Н2↑(г)
1.6. 3 Н2(г) + N2(г) → 2NН3(г)
1.7. CaCO3(к)→ CaO(к) + CO2(г)
1.8. CO(г) + H2O(г)→ CO2(г) + Н2(г)
1.9. 4NO2 + O2(г) + 2H2O(г)→ 4HNO3(ж)
- Напишите выражение константы равновесия для следующих химических реакций:
2.0. Н2(г) + Cl2(г) ↔ 2HCl(г)
2.1. 2H2O(г) ↔ 2H2(г) + O2(г)
2.2. N2(г) + 3H2(г) ↔ 2NH3(г)
2.3. CO(г) + Cl2(г) ↔ COCl2(г)
2.4. SO3(г) + C(к) ↔ SO2(г) + CO(г)
2.5. CaCO3(к) ↔ CaO(к) + CO2(г)
2.6. 2H2S(г) + 3O2(г) ↔ SO2(г) + 2H2O(г)
2.7. Fe2O3(к) + CO(г) ↔ 2FeO(к) + CO2(г)
2.8. CaO(к) + 3C(к) ↔ CaC2(к) + CO(г)
2.9. H2(г) + I2(г) ↔ 2HI(г) (t0 комнатная)
Химическое равновесие. Роль катализа в жизнедеятельности организма.
1. Если на систему, находящуюся в равновесии оказать внешнее воздействие - изменить температуру Т, концентрацию С, давление Р, то равновесие сместится в сторону ослабления оказанного воздействия. Это:
1. закон сохранения массы веществ
2. закон действующих масс
3. закон сохранения энергии
4. закон Гесса
5. принцип Ле Шателье
2. Вещества, небольшие количества которых сильно замедляют скорость химической реакции, называются:
1. ингибиторами
2. индикаторами
3. ферментами
4. промоторами
5. каталитическими ядами
3. По своей природе ферменты (энзимы) - это:
1. только углеводы простые и сложные
2. только сложные неорганические соединения
3. простые и сложные неорганические соединения
4. специфические простые и сложные белки
5. только простые белки
4. При химическом равновесии длительно остаются постоянными в системе:
1. давление
2. температура
3. концентрация исходных веществ
4. концентрация продуктов
5. температура, давление и концентрация всех веществ
5. Механизм положительного действия катализатора на скорость химической реакции заключается
1. в измельчении реагирующих веществ
2. в повышении энергии активации реакции
3. в понижении энергии активации реакции
4. в образовании газообразных веществ
5. в повышении температуры реакционной системы
6. На скорость реакции, протекающей в жидкой фазе, не влияет
1. концентрация реагирующих веществ
2. температура
3. природа реагирующих веществ
4. присутствие катализатора
5. давление
7. Чтобы увеличить выход аммиака по экзотермической реакции
N2(г) + 3H2(г) «2NH3(г) + Q надо:
1. повысить температуру и концентрацию азота
2. понизить температуру и концентрацию азота
3. понизить температуру и концентрацию водорода
4. понизить температуру и увеличить концентрацию азота
5. уменьшить концентрацию азота и водорода
- Если катализатор и реагирующие вещества находятся в разных фазах, то катализ называется
1. независимым
2. гетерогенным
3. автокатализом
4. гомогенным
5. коллоидным
9. Механизм положительного действия катализатора на скорость химической
реакции заключается
1. в измельчении реагирующих веществ
2. в повышении энергии активации реакции
3. в снижении энергии активации реакции
4. в образовании газообразных веществ
5. в повышении температуры реакционной системы
10. Снижение скорости ферментативной реакции при достижении определенной температуры объясняется
1. высокой каталитической активностью фермента
2. высокой селективностью фермента
3. тепловой денатурацией ферментов, т.е. их инактивацией
4. амфотерными свойствами белка
5. зависимостью скорости реакции от концентрации субстрата
1. Тема №2: Медико биологическое значение – s,-p-,d-элементов. Применение их соединения в медицине.
2. Цель: Изучить химию биогенных элементов, их общие свойства и особенности. Учение В.И. Вернадского о биосфере и биогеохимии. Изучить закономерности распределения биогенных элементов по s-, p-, d-блокам ПСЭ, их топографию в организме человека, биологическое значение и медицинское применение.
3. Задания:
1. Распространенность химических элементов в земной коре. Учение В.Вернадского о биосфере и биогеохимии.
2. Макро- и микроэлементы организма человека и окружающей среды.
3. Биогенные элементы. Связь эпидемий с особенностями биохимических провинций.
4. Закономерности распределения биогенных элементов по s-, p-, d-блокам ПСЭ. Топография важных биогенных элементов в организме человека.
5. Биологическая роль и медицинское применение биогенных элементов.
4. Форма выполнения: Защита реферата, выполнение контроля.
5. Критерии выполнения:
Рефератвыполняется объемом 6-8 страниц, Для написания реферата нужно использовать 5-7 и более литературных источников и делать ссылки на них в соответствии с требованиями ГОСТ. Реферат должен иметь титульный лист. На титульном листе указываются наименование ВУЗа, кафедры, курса, темы реферата, факультет, номер группы и фамилия исполнителя, фамилия и должность проверяющего реферат, город, год. На второй странице помещают содержание реферата с указанием страниц. Все страницы реферата, графики, рисунки, формулы и уравнения химических реакций должны быть пронумерованы. К рисункам и таблицам должны быть даны названия. Рефераты сдают на кафедру. Контроль по материалам внеаудиторной СРС преподаватель проводит путем устного или письменного опроса, тестирование и др. Реферат выполняется на бумаге формата А4, шрифт Times New Roman, кегль 14, полуторный интервал. Поля: слева – 30 мм, справа – 10 мм, сверху, снизу – 20 мм.
6. Сроки сдачи: 4 неделя
7. Критерии оценки: по шкале оценки СРС (согласно критериям выполнения)
8. Литература:
Основная литература:
1. Биоорганическая химия: учебник. Тюкавкина Н.А., Бауков Ю.И. 2014г.
- Сейтембетов Т.С. Химия: учебник - Алматы: ТОО"ЭВЕРО", 2010. - 284 с
- Болысбекова С. М. Химия биогенных элементов: учебное пособие - Семей, 2012. - 219 с.: ил
- Веренцова Л.Г. Неорганическая,физическая и коллоидная химия: учебное пособие - Алматы: Эверо, 2009. - 214 с.: ил.
- Физическая и коллоидная химия /Под ред.А.П.Беляева.- М.: ГЭОТАР МЕДиа, 2008
- Веренцева Л.Г. Неорганическая, физическая и коллоидная химия,(проверочные тесты) 2009
Дополнительная литература:
- Равич-Щербо М.И., Новиков В.В. Физическая и коллоидная химия. М. 2003.
2. Слесарев В.И. Химия. Основы химии живого. С-Пб.: Химиздат, 2001
3. Ершов Ю.А. Общая химия. Биофизическая химия. Химия биогенных элементов. М.: ВШ, 2003.
4. Асанбаева Р.Д., Илиясова М.И. Теоретические основы строения и реакционной способности биологически важных органических соединений. Алматы, 2003.
- Руководство к лабораторным занятиям по биоорганической химии под ред. Н.А. Тюкавкиной. М., Дрофа,2003.
- Глинка Н.Л. Общая химия. М.,2003.
- Пономарев В.Д. Аналитическая химия ч.1,2 2003
Контроль
- Биологическая роль и медицинские применение элементов I и II группы П.С.Э.
- Почему металлоферменты марганца II активно участвуют в О.В.Р.
- Какова биологическая роль железа?
- Перечислите макроэлементы, входящие в живой организм
- Объясните механизм ядовитого действия угарного газа СО
- При лечении каких заболеваний используются соединения йода и фтора?
- Поясните механизм токсического действия на организм тяжелых металлов, таких как медь, свинец, ртуть и др.
1. Тема №3: Коллигативные свойства растворов. Осмотическое и онкотическое давление. Изотонический коэффициент.
2. Цель: Изучить коллигативные своиства растворов, что позволяет понять сущность осмотических процессов в организме.
3. Задания:
- Осмос
- Осмотическое давление неэлектролитов Закон Вант-Гоффа
- Онкотическое давление
- Осмотическое давление электролитов, изотоническии коэффициент
- Гипо,- гипер- и изотонические растворы, их использование в медицинской практике
- Использование гипо,- гипер- и изотонических растворов в медицинской практике
Задачи и упражнения:
- Осмотическое давление физиологического раствора при 370С равно 7,6 атм. определить молярную концентрацию хлорида натрия NaCl в физ. растворе, если степень диссоциации NaCl равна 1 (R=0.082 (л∙атм)/(К∙моль))?
- Эмбулиометрическая константа воды равна 0,520. 2 кг воды содержит 2,75 моль глюкозы. Рассчитать температуру кипения раствора
- Что такое экзосмос?
- Рассчитать осмотическое давление, если концентрация веществ в крови кролика равна 0,44 моль/л, (R=0.082 (л∙атм)/(К∙моль) и температура 370С?
- Криометрическая константа воды 1,860С. 1 кг воды содержит 2 моль неэлектролита. Рассчитать температуру замерзания раствора?
- Что такое гипертонический и изотонический растворы?
4. Форма выполнения: Ответы на основные вопросы темы, выполнение контроля, решение задач и упражнений.
5. Критерии выполнения: Уметь правильно оформлять условие, решение задачи, знать формулировку и математическую запись основных формул.
6. Сроки сдачи: 7 неделя
7. Критерии оценки: по шкале оценки СРС (согласно критериям выполнения)
8. Литература:
Основная литература:
1. Биоорганическая химия: учебник. Тюкавкина Н.А., Бауков Ю.И. 2014г.
2. Сейтембетов Т.С. Химия: учебник - Алматы: ТОО"ЭВЕРО", 2010. - 284 с
3. Болысбекова С. М. Химия биогенных элементов: учебное пособие - Семей, 2012. - 219 с.: ил
4. Веренцова Л.Г. Неорганическая,физическая и коллоидная химия: учебное пособие - Алматы: Эверо, 2009. - 214 с.: ил.
5. Физическая и коллоидная химия /Под ред.А.П.Беляева.- М.: ГЭОТАР МЕДиа, 2008
6. Веренцева Л.Г. Неорганическая, физическая и коллоидная химия,(проверочные тесты) 2009
Дополнительная литература:
- Равич-Щербо М.И., Новиков В.В. Физическая и коллоидная химия. М. 2003.
2. Слесарев В.И. Химия. Основы химии живого. С-Пб.: Химиздат, 2001
3. Ершов Ю.А. Общая химия. Биофизическая химия. Химия биогенных элементов. М.: ВШ, 2003.
4. Асанбаева Р.Д., Илиясова М.И. Теоретические основы строения и реакционной способности биологически важных органических соединений. Алматы, 2003.
- Руководство к лабораторным занятиям по биоорганической химии под ред. Н.А. Тюкавкиной. М., Дрофа,2003.
- Глинка Н.Л. Общая химия. М.,2003.
- Пономарев В.Д. Аналитическая химия ч.1,2 2003
Контроль
Студенту при защите СРС предлагается решить задачи, последняя цифра номера которых совпадает с последней цифрой номера, под которым студент записан в журнале.
1. Вычислите осмотическое давление раствора при 250С
1.0. глицерина С=1 моль/л
1.1. сахарозы С=0,5 моль/л
1.2. глюкозы С=0,5 моль/л
1.3. NaCl (α =1) С=0,15 моль/л
1.4. Мочевины (CO(NH2)2) С=1 моль/л
1.5. HCl С=0,2 моль/л (α =1)
1.6. Na2SO4 С=0,1 моль/л (α =0,9)
1.7. NH4OH С=0,1 моль/л (α =0,1)
1.8. Na3PO4 С=0,01 (α =0,9)
1.9. Глюкозы С=1 моль/л
Газовая постаянная R=0,082 атм/моль К0
2. Определить t0 замерзания и кипения раствора, если в 200 г воды растворить:
2.0. 5г сахара
2.1. 0,2 моль бензола
2.2. 1 моль мочевины
2.3. 0.1 моль Na2SO4 (α =0,9)
2.4. 6,3г HNO3 (α =0,82)
2.5. 6,4г CH3COOH (α =0,01)
2.6. 4г NaOH (α =1)
2.7. 1,8 г NaCl (α =1)
2.8. 15 г бензола
КН2О=1,860С ЕН2О=0,520С
1. Тема №4: Дисперсные системы. Классификация и свойства. Электрофоретические методы исследования в медицине.
2. Цель: Изучить основы физико–химии дисперсных систем, так как многие жидкости и ткани организма человека относятся к дисперсным системам. Ознакомиться со свойствами и методами их исследования коллоидных систем: диализ, электродиализ, электроосмос.
3. Задания:
1. Гомогенные и гетерогенные термодинамические системы. Фаза.
- Классификация дисперсных систем: по размеру частиц дисперсной фазы;
по агрегатному состоянию; по интенсивности взаимодействия дисперсной фазы и дисперсионной среды.
- Методы получения и способы очистки коллоидных растворов.
- Строение мицеллы гидрофобного золя.
- Свойства коллоидных растворов, устойчивость лиозолей. Коагуляция золей. Коллоидная защита
- Диализ. Электродиализ. Электрофорез. Электроосмос.
- Применение и биологическая роль коллоидных систем в организме.
Задачи и упражнения:
№1. Золь иодида серебра стабилизирован избытком нитрата серебра AgNO3. Написать формулу мицеллы золя йодида серебра, указать гранулу и ее заряд.
№2. Золь хлорида серебра получен при взаимодействии нитрата серебра AgNO3 с избытком хлорида натрия. Написать формулу мицеллы золя. Указать потенциалопределяющие ионы, диффузный слой, противоионы.
№3. Золь иодида серебра, полученный по реакции: КI + AgNO3 = AgI + КNO3, при избытке КI, коагулируют растворами К2SО4 и Са(СН3СОО)2. Объясните коагулирующее действие, какого электролита сильнее. Запишите формулу мицеллы золя.
№4. Написать формулу мицеллы гидрозоля Аl(ОН)3 если стабилизатором является А1С13. Что произойдет при смешивании равных количеств данного золя с «отрицательным» золем берлинской лазури Fе4 [Fe(CN)6]3?
№5.Применяемое в медицине антисептическое средство, гидрозоль окиси серебра получен по реакции: 2AgNO3 + 2КОН = Ag2О + 2КNO3 + Н2О при избытке AgNO3. Написать формулу мицеллы Ag2О.
№6. Строение мицеллы отвечает по формуле:
{[H2SiO3]m∙nSiO32-∙(2n–x)H+}x-∙xH+∙yH2O.Указать ядро, потенциалопределяющие ионы, адсорбционный слой, диффузный слой и гранулу мицеллы золя.
4. Форма выполнения: Защита реферата, выполнение контроля, решение задач и упражнений.
5. Критерии выполнения:
Рефератвыполняется объемом 6-8 страниц, Для написания реферата нужно использовать 5-7 и более литературных источников и делать ссылки на них в соответствии с требованиями ГОСТ. Реферат должен иметь титульный лист. На титульном листе указываются наименование ВУЗа, кафедры, курса, темы реферата, факультет, номер группы и фамилия исполнителя, фамилия и должность проверяющего реферат, город, год. На второй странице помещают содержание реферата с указанием страниц. Все страницы реферата, графики, рисунки, формулы и уравнения химических реакций должны быть пронумерованы. К рисункам и таблицам должны быть даны названия. Рефераты сдают на кафедру. Контроль по материалам внеаудиторной СРС преподаватель проводит путем устного или письменного опроса, тестирование и др. Реферат выполняется на бумаге формата А4, шрифт Times New Roman, кегль 14, полуторный интервал. Поля: слева – 30 мм, справа – 10 мм, сверху, снизу – 20 мм.
6. Сроки сдачи: 8 неделя
7. Критерии оценки: по шкале оценки СРС (согласно критериям выполнения)
8. Литература:
Основная литература:
Основная литература:
1. Биоорганическая химия: учебник. Тюкавкина Н.А., Бауков Ю.И. 2014г.
- Сейтембетов Т.С. Химия: учебник - Алматы: ТОО"ЭВЕРО", 2010. - 284 с
- Болысбекова С. М. Химия биогенных элементов: учебное пособие - Семей, 2012. - 219 с.: ил
- Веренцова Л.Г. Неорганическая,физическая и коллоидная химия: учебное пособие - Алматы: Эверо, 2009. - 214 с.: ил.
- Физическая и коллоидная химия /Под ред.А.П.Беляева.- М.: ГЭОТАР МЕДиа, 2008
- Веренцева Л.Г. Неорганическая, физическая и коллоидная химия,(проверочные тесты) 2009
Дополнительная литература:
- Равич-Щербо М.И., Новиков В.В. Физическая и коллоидная химия. М. 2003.
2. Слесарев В.И. Химия. Основы химии живого. С-Пб.: Химиздат, 2001
3. Ершов Ю.А. Общая химия. Биофизическая химия. Химия биогенных элементов. М.: ВШ, 2003.
4. Асанбаева Р.Д., Илиясова М.И. Теоретические основы строения и реакционной способности биологически важных органических соединений. Алматы, 2003.
- Руководство к лабораторным занятиям по биоорганической химии под ред. Н.А. Тюкавкиной. М., Дрофа,2003.
- Глинка Н.Л. Общая химия. М.,2003.
- Пономарев В.Д. Аналитическая химия ч.1,2 2003
Контроль
1.Студенту при подготовке СРС предлагается выполнить упражнения, последняя цифра номера которых совпадает с последней цифрой номера, под которым студент записан в журнале.
1. Написать формулу мицеллы золя:
1.0. Al(OH)3 стабилизированного AlCl3
1.1. SiO2 стабилизированного H2SiO3
1.2. Au стабилизированного KАuO2
1.3. AgI стабилизированного KI
1.4. AgI стабилизированного AgNO3
1.5. Fe(OH)3 стабилизированного FeCl3
1.6. As2S3 стабилизированного H2S
1.7. CuS стабилизированного H2S
1.8. Fe(OH)3 стабилизированного FeOCl
1.9. AgCl стабилизированного NaCl
Определить знак заряда частиц данного золя. Обозначить ядро, гранулу, адсорбционный и диффузионный слой.
1. Тема №5: Классификация органических соединений. Углеводороды. Алканы, алкены, арены. Строение, реакционная способность.
2. Цель: Сформировать представление о единстве строения и химических свойств органических соединений как основы для дальнейшего понимания связи между строением и биологической активностью соединений.
3. Задания: составить глоссарий по основным понятиям темы, ответить на основные вопросы темы, выполнить контроль, решить задачи и упражнения.
1. Классификация органических соединений
2. Алканы. Строение, гомологический ряд алканов.
3. Реакции радикального замещения у насыщенного атома углерода (SR).
а) галогенирование
б) окисление.
4. Алкены. Строение, номенклатура.
5. Реакции электрофильного присоединения к ненасыщенными углеводородам
а) галогенирование
б) гидратация
в) гидрогалогенирование
6. Правило Марковникова.
7. Арены. Реакции электрофильного замещения (SЕ)
а) галогенирование
б) алкилирование и ацилирование
в) нитрование
г) сульфирование
8. Ориентирующее действие заместителей в бензольном ядре.
9. Конкурентные реакции нуклеофильного замещения (SN) и элиминирования (Е) у насыщенного атома углерода.
4. Форма выполнения: Глоссарий. Выполнение контроля.
5. Критерии выполнения:
Критерии выполнения задания - условия, влияющие на оценочный балл:
- Объем глоссария - 20-25 терминов
- Конкретно разъяснить значение каждого термина.
- Показать важность значения истолкованных слов по выбранной Вами теме
- При написании терминов строго следовать алфавитной последовательности.
- Необходимо вписать все значения терминов.
- Формат А4, шрифт Times New Roman, кегль 14, полуторный интервал. Поля: слева - 30 мм, справа - 10 мм, сверху, снизу - 20 мм.
- Своевременность сдачи. При сдаче СРС позже установленного срока оценка снижается.
6. Сроки сдачи: 9 неделя
7. Критерии оценки: по шкале оценки СРС (согласно критериям выполнения)
8. Литература:
Основная литература:
1. Биоорганическая химия: учебник. Тюкавкина Н.А., Бауков Ю.И. 2014г.
2. Сейтембетов Т.С. Химия: учебник - Алматы: ТОО"ЭВЕРО", 2010. - 284 с
3. Болысбекова С. М. Химия биогенных элементов: учебное пособие - Семей, 2012. - 219 с.: ил
4. Веренцова Л.Г. Неорганическая,физическая и коллоидная химия: учебное пособие - Алматы: Эверо, 2009. - 214 с.: ил.
5. Физическая и коллоидная химия /Под ред.А.П.Беляева.- М.: ГЭОТАР МЕДиа, 2008
6. Веренцева Л.Г. Неорганическая, физическая и коллоидная химия,(проверочные тесты) 2009
Дополнительная литература:
- Равич-Щербо М.И., Новиков В.В. Физическая и коллоидная химия. М. 2003.
2. Слесарев В.И. Химия. Основы химии живого. С-Пб.: Химиздат, 2001
3. Ершов Ю.А. Общая химия. Биофизическая химия. Химия биогенных элементов. М.: ВШ, 2003.
4. Асанбаева Р.Д., Илиясова М.И. Теоретические основы строения и реакционной способности биологически важных органических соединений. Алматы, 2003.
- Руководство к лабораторным занятиям по биоорганической химии под ред. Н.А. Тюкавкиной. М., Дрофа,2003.
- Глинка Н.Л. Общая химия. М.,2003.
- Пономарев В.Д. Аналитическая химия ч.1,2 2003
Контроль
1. Назвать по систематической номенклатуре вещества:
| 1.0. | 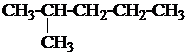
| 1.5. | 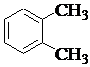
|
| 1.1. | 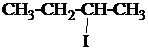
| 1.6. | 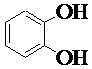
|
| 1.2. |
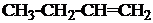
| 1.7. | 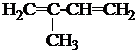
|
| 1.3. | 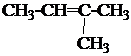
| 1.8. | 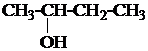
|
| 1.4. | 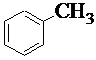
| 1.9. |
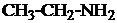
|
2. Напишите уравнение реакции сульфирования бензойной кислоты. Как влияет карбоксильная группа на реакционную способность в бензольном кольце.
1. Тема №6: Реакция окисления и восстановления спиртов, тиолов, сульфидов, карбоновых соединений, аминов.
2. Цель: Сформировать знания способности органических соединении к окислению и восстановлению как фундаментальных свойств, обусловливающих протекание большинства химических реакций в живых организмах.
3. Задания: Эссе
4. Форма выполнения: Эссе. Выполнение контроля, решение задач и упражнений.
5. Критерии выполнения:
Критерии выполнения задания- условия, влияющие на оценочный балл:
- В эссе должно быть отражено творческое мышление, критическое осмысление, анализ и письменное изложение четко сформулированных и ясно выраженных собственных мыслей студента;
- Структура эссе должна включать: введение, основную часть, заключение;
- Объем эссе - 5-7 листов;
- Аргументированность выводов и предложений;
- Тщательность проведения анализа;
- Индивидуальность эссе, его отличие от работ других студентов (избегать «слепого копирования»)
- Наличие в конце списка ссылок на литературные источники
- Формат А4, шрифт Times New Roman, кегль 14, полуторный интервал. Поля: слева - 30 мм, справа - 10 мм, сверху, снизу - 20 мм.
Своевременность сдачи. При сдаче СРС позже установленного срока оценка снижается.
6. Сроки сдачи: 10 неделя
7. Критерии оценки: по шкале оценки СРС (согласно критериям выполнения)
8. Литература:
Основная литература:
1. Биоорганическая химия: учебник. Тюкавкина Н.А., Бауков Ю.И. 2014г.
- Сейтембетов Т.С. Химия: учебник - Алматы: ТОО"ЭВЕРО", 2010. - 284 с
- Болысбекова С. М. Химия биогенных элементов: учебное пособие - Семей, 2012. - 219 с.: ил
- Веренцова Л.Г. Неорганическая,физическая и коллоидная химия: учебное пособие - Алматы: Эверо, 2009. - 214 с.: ил.
- Физическая и коллоидная химия /Под ред.А.П.Беляева.- М.: ГЭОТАР МЕДиа, 2008
- Веренцева Л.Г. Неорганическая, физическая и коллоидная химия,(проверочные тесты) 2009
Дополнительная литература:
- Равич-Щербо М.И., Новиков В.В. Физическая и коллоидная химия. М. 2003.
2. Слесарев В.И. Химия. Основы химии живого. С-Пб.: Химиздат, 2001
3. Ершов Ю.А. Общая химия. Биофизическая химия. Химия биогенных элементов. М.: ВШ, 2003.
4. Асанбаева Р.Д., Илиясова М.И. Теоретические основы строения и реакционной способности биологически важных органических соединений. Алматы, 2003.
- Руководство к лабораторным занятиям по биоорганической химии под ред. Н.А. Тюкавкиной. М., Дрофа,2003.
- Глинка Н.Л. Общая химия. М.,2003.
- Пономарев В.Д. Аналитическая химия ч.1,2 2003
Контроль
1. Метиловый спирт при попадании в организм вызывает тяжелое отравление, сопровождающееся потерей зрения. Полагают, что потеря зрения вызвана взаимодействием продукта окисления метанола с белками сетчатки глаза. Напишите реакцию окисления метанола.
2. Пропанол–1 содержится в сивушных маслах, получаемых в небольшом количестве при спиртовом брожении. Напишите реакцию окисления пропанола-1 в соответствующую кислоту. Какой промежуточный продукт образуется в ходе этой реакции? Сравните способность к окислению пропанола-1 и промежуточного продукта реакции.
3. В организме пировиноградная (2-оксопропановая) кислота восстанавливается в молочную кислоту. Напишите реакцию восстановления пировиноградной кислоты.
4. Напишите схему реакции окисления толуола. Назовите продукт реакции.
5. Дайте определение понятиям «окисление», «восстановление». Оцените способность к окислению первичных, вторичных и третичных спиртов, альдегидов, кетонов и тиолов.
6. Напишите схему окислительно–восстановительного взаимопревращения цистеина и цистина.
1. Тема №7: Аминоспирты, аминофенолы и их биологическая роль.
2. Цель: Сформировать знания специфических химических свойств гетерофункциональных соединений как основу для понимания их метаболических превращений в организме.
3. Задания:
1. Аминоспирты. Определение.
а) 2-аминоэтанол (коламин), биологическая роль.
б) димедрол, медицинское применение
в) холин, строение биологическая роль, использование в медицине производных холина
г) Катехоламины а) адреналин, б) норадреналин, в) дофамин
2. n-Аминофенол и его производные
а) парацетомол.
б) фенацетин
в) фенетидин.
4. Форма выполнения: Ответы на основные вопросы темы, выполнение контроля, решение задач и упражнений.
5. Критерии выполнения: Уметь правильно записывать химические формулы, уравнение реакции.
6. Сроки сдачи: 11 неделя
7. Критерии оценки: по шкале оценки СРС (согласно критериям выполнения)
8. Литература:
Основная литература:
1. Биоорганическая химия: учебник. Тюкавкина Н.А., Бауков Ю.И. 2014г.
- Сейтембетов Т.С. Химия: учебник - Алматы: ТОО"ЭВЕРО", 2010. - 284 с
- Болысбекова С. М. Химия биогенных элементов: учебное пособие - Семей, 2012. - 219 с.: ил
- Веренцова Л.Г. Неорганическая,физическая и коллоидная химия: учебное пособие - Алматы: Эверо, 2009. - 214 с.: ил.
- Физическая и коллоидная химия /Под ред.А.П.Беляева.- М.: ГЭОТАР МЕДиа, 2008
- Веренцева Л.Г. Неорганическая, физическая и коллоидная химия,(проверочные тесты) 2009
Дополнительная литература:
- Равич-Щербо М.И., Новиков В.В. Физическая и коллоидная химия. М. 2003.
2. Слесарев В.И. Химия. Основы химии живого. С-Пб.: Химиздат, 2001
3. Ершов Ю.А. Общая химия. Биофизическая химия. Химия биогенных элементов. М.: ВШ, 2003.
4. Асанбаева Р.Д., Илиясова М.И. Теоретические основы строения и реакционной способности биологически важных органических соединений. Алматы, 2003.
- Руководство к лабораторным занятиям по биоорганической химии под ред. Н.А. Тюкавкиной. М., Дрофа,2003.
- Глинка Н.Л. Общая химия. М.,2003.
- Пономарев В.Д. Аналитическая химия ч.1,2 2003
Контроль
1. Напишите схемы реакций получения производных n-аминофенола, имеющих лекарственное значение: этилового эфира n-аминофенола (фенетедин), этилового эфира N–ацетил-n-амнофенола (фенацетин), n-ацетаминофенола (парацетамол)
2. Напишите структурную формулу фосфатидилколамина (кефалина) содержащего остатки олеиновой и стеариновой кислот. Какие продукты получаются в результате его гидролитического расщепления?
3. Напишите структурную формулу фосфатидилхолина (лецитина), содержащего остатки олеиновой и стеариновой кислот. Какие продукты получаются в результате его гидролитического расщепления?
4. Напишите формулу лецитина, включающую пальмитиновую и ленолевую кислоты. Какой из ацильных остатков данного фосфолипида может подвергаться пероксидному окислению? Напишите схему реакции.
5. Какая аминокислота является источником синтеза в организме адреналина?
6. Перечислите производные холина, используемые как лекарственные средства.
7. На каких свойствах основано действие инсектицидов и нервно-паралитических ядов зарина, табуна.
1. Тема №8: Конформации пиранозных форм гексоз. О и N-гликозиды. Гидролиз гликозидов. Ацилирование аминосахаров.
2. Цель: Cформировать знания конфармационного, стереохимического строения и таутомерных форм моносахаридов как основу для понимания их метаболических превращений в организме и структурной организации полисахаридов. Изучить свойства важнейших производных углеводов: O- и N –гликозиды и аминосахара.
3. Задания:
- Циклические формы моносахаридов (пиранозные и фуранозные)
- Конформации пиранозных форм гексоз, влияние их на формирование пространственного строения полисахаридов
- Производные моносахаридов
а) O- и N-гликозиды, их строение, биологическая роль, гидролиз гликозидов
4. Аминосахара, строение, биологическая роль.
а) глюкозамин, галактозамин
б) нейраминовая кислота и ее производные – сиаловые кислоты
4. Форма выполнения: Ответы на основные вопросы темы, выполнение контроля, решение задач и упражнений.
5. Критерии выполнения: Уметь правильно записывать химические формулы, уравнение реакции.
6. Сроки сдачи: 13 неделя
7. Критерии оценки: по шкале оценки СРС (согласно критериям выполнения)
8. Литература:
Основна<