Каждый, кому приходилось разрушать бактериальные клетки в мягких условиях, например с помощью лизоцима или детергентов, наблюдал
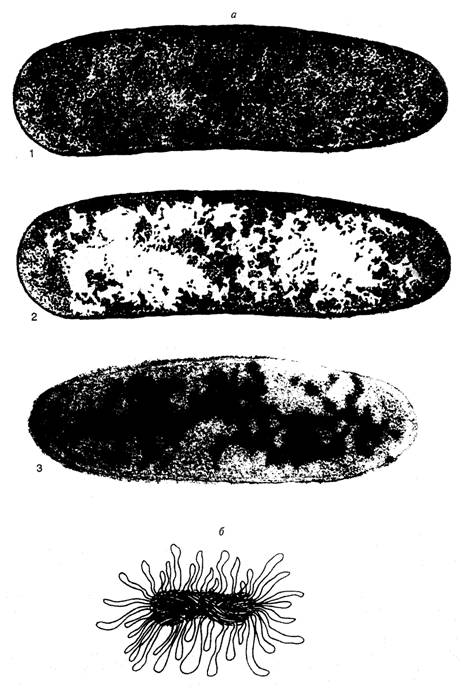
Рис. I.1. Нуклеоид E. coli
а – электронно-микроскопические фотографии срезов бактериальных клеток, полученные методом криофиксации. 1 и 2 – один и тот же снимок (последний ретуширован). На фотографии 2 белыми пятнами отмечены области цитоплазмы, свободные от рибосом. На фотографии 3 видны молекулы ДНК, специфически окрашенные с помощью антител;
б – модель нуклеоида в функционально-активном состоянии А. Райтера и А. Чанга. Изображены многочисленные петли активно транскрибируемой ДНК
замечательную картину превращения легко подвижной суспензии бактериальных клеток в вязкую желеобразную массу, простое перемешивание которой требует усилий. Это происходит из-за того, что компактно упакованные гигантские хромосомы бактериальных клеток (длина хромосомной ДНК E. coli составляет ~4,6 млн. п.о.) после разрушения оболочки клеток выходят в окружающую среду и свободно в ней распределяются. В лизатах бактериальных клеток их ДНК прочно ассоциированы с белками, освобождение от которых требует проведения многократных фенольных депротеинизаций. Такой простой опыт наглядно указывает на то, что в бактериальных клетках их единственная хромосома сильно компактизована и, возможно, пространственно упорядочена.
Электронно-микроскопическое изучение срезов бактериальных клеток в разных условиях и более ранние исследования бактерий с помощью светового микроскопа продемонстрировали компактное распределение ДНК в бактериальной клетке. Поскольку такие структуры отдаленно напоминали ядра эукариот, они получили название нуклеоидов, или ДНК-плазмы. Эти термины подчеркивают генетические функции нуклеоида, но в то же время и существенные морфологические отличия от обычных интерфазных ядер эукариот, прежде всего, отсутствие ядерной оболочки, которая бы отделяла гены бактерии от окружающей их цитоплазмы. Исследование бактериальных клеток с помощью электронной микроскопии в мягких условиях без предварительной химической фиксации показало, что нуклеоиды представлены в виде диффузно окрашенных областей, свободных от рибосом (рис. I.1, а). При этом вытянутые участки ДНК на внешней части нуклеоидов направлены в окружающую цитоплазму. С помощью специфических антител установлено, что молекулы РНК-полимеразы, ДНК-топоизомеразы I и гистоноподобного белка HU ассоциированы с нуклеоидами. Вытянутые участки ДНК по периферии нуклеоидов обычно интерпретируют как сегменты бактериальной хромосомы, вовлеченные в транскрипцию. Полагают, что эти участки состоят из петель ДНК бактериальной хромосомы, которые в зависимости от физиологического состояния клетки находятся в транскрипционно-активном состоянии или втягиваются внутрь нуклеоидов при подавлении транскрипции. Модель функционально-активного нуклеоида А.Райтера и А.Чанга представлена на рис. I.1, б. По мнению авторов, размытая структура поверхности нуклеоидов, видимая под электронным микроскопом, отражает подвижное состояние активно транскрибируемых петель ДНК. В этой модели четко прослеживается аналогия со структурой хромосом типа ламповых щеток у животных.
Таким образом, нуклеоид бактериальных клеток не является статическим внутриклеточным образованием или компартментом, которые можно четко определять морфологически. Напротив, во время различных фаз роста бактериальных клеток нуклеоид непрерывно меняет форму, что, по-видимому, сопряжено с транскрипционной активностью определенных бактериальных генов. Так же как и в хромосомах эукариот, ДНК нуклеоида ассоциирована со многими ДНК-связывающими белками, в частности гистоноподобными белками HU, H-NS и IHF, а также топоизомеразами, которые оказывают большое влияние на функционирование бактериальных хромосом и их внутриклеточную компактизацию. Однако детальные молекулярные механизмы конденсации бактериальной ДНК с образованием лабильных " компактосом " (по аналогии со стабильными нуклеосомами эукариот) пока неизвестны. В последнее время возрастает интерес к бактериальному так называемому LP-хроматину (low protein chromatin), для которого характерно относительно низкое содержание белкового компонента. Аналогичный LP-хроматин обнаруживают у вирусов, в митохондриях, пластидах и у динофлагеллят (жгутиконосцев). Следовательно, этот тип структурной организации генетического материала претендует на универсальность и ассоциирован с определенными формами регуляции экспрессии генов, свойственными прокариотическим организмам.
В последние годы наблюдается прогресс в исследовании первичной структуры бактериальных хромосом. Определена полная последовательность нуклеотидов хромосом паразитических бактерий: микоплазмы Mycoplasma genitalium и Haemophilus influenzae. В 1997 г. усилиями интернационального коллектива ученых была определена полная первичная структура хромосом E. coli и Bacillus subtilis длиной в ~4,6 и 4,2 млн п.о. соответственно Все это позволяет надеяться, что в ближайшее время произойдут новые открытия в области исследований структуры бактериальных геномов и функционирования их генов.
Геном архебактерий
Царство архебактерий представляет собой своеобразную и наименее изученную таксономическую группу прокариот. Хотя по своей морфологии Archeabacteria похожи на привычные эубактерии, на молекулярном уровне они сближены с эукариотами. Эти микроорганизмы часто рассматривают как прокариотические эволюционные предшественники эукариот, в связи с чем представляется целесообразным рассмотреть строение генома архебактерий более подробно.
Архебактерия Methanococcus jannaschii, первичная структура генома которой была полностью определена в 1996 г., обнаружена в горячих морских глубоководных источниках. Энергию для жизнедеятельности этот микроорганизм получает при восстановлении двуокиси углерода до метана молекулярным водородом. Температура, близкая к температуре кипящей воды, является оптимальной для его роста, который может происходить при давлении более 200 атм. M. jannaschii не требует для своего роста органических соединений: все необходимое для жизни он синтезирует из неорганических веществ – CO2, NH3 и т.п. Геном M. jannaschii состоит из основной кольцевой хромосомы и двух небольших внехромосомных элементов, размеры которых составляют соответственно 1700, 58 и 16 т.п.о. Подобные размеры геномов типичны для архе- и эубактерий. Интересно, что GC-состав ДНК этого ярко выраженного термофила невысок и составляет всего 31%. Геном организован компактно: обнаружено ~1700 потенциальных кодирующих участков ДНК, по одному на каждые 1000 п.о.
Многие ДНК-локусы M. jannaschii не обнаруживают гомологии с уже известными последовательностями. Функциональное значение большого числа потенциальных кодирующих последовательностей генома этого микроорганизма остается невыясненным. Таким образом, M. jannaschii отличается от других прокариот и эукариот большим набором только ему свойственных генов и функций. Анализ структуры генома M. jannaschii показал, что гены, организующие системы обработки генетической информации – транскрипции, трансляции и репликации ДНК, в большей степени напоминают гены эукариот, чем бактерий. При этом гены системы трансляции оказались наиболее консервативными (обладали наибольшей гомологией) у прокариот, эукариот и архебактерий. Из них гены рРНК – универсальны, так же как и гены некоторых рибосомных белков. Специфические рибосомные белки M. jannaschii имеют гомологов у эукариот, но не у эубактерий. Большинство распознанных факторов трансляции у этой архебактерии также оказалось эукариотического типа. То же, хотя и в меньшей степени, относится к аминоацил-тРНК-синтетазам.
При сравнительном анализе генов системы транскрипции оказалось, что РНК-полимеразы M. jannaschii и эубактерий обнаруживают гомологию среди субъединиц, формирующих минимальный фермент, однако архебактерия обладает малыми дополнительными субъединицами, которые не свойственны эубактериям, а их гомологи имеются у РНК-полимераз эукариот. Лишь два из основных факторов транскрипции M. jannaschii гомологичны таковым эукариот, а один или два фактора рассматриваются, как "рудиментарные" формы соответствующих эукариотических факторов. Таким образом, система транскрипции архебактерий сегодня представляется как более простая и, возможно, более примитивная версия соответствующей эукариотической системы.
В геноме M. jannaschii найден только один ген, кодирующий ДНК-полимеразу, которая напоминает эукариотическую ДНК-полимеразу e. ДНК-полимераза Pol III, осуществляющая репликацию ДНК у эубактерий, не имеет гомолога у M. jannaschii. Высокую гомологию с белками эукариот обнаруживают и другие белки архебактерии: гистоны, белки, контролирующие деление клетки, протеасомы, факторы элонгации трансляции, белки систем репарации и транспорта. Для M. jannaschii, как и для эубактерий, характерна организация генов в виде оперонов. Однако в первом случае опероны встречаются редко и почти всегда объединяют гены субъединиц белковых комплексов, например РНК-полимеразы, рибосом или метил-коэнзим М-редуктазы. В то же время довольно редки опероны, содержащие гены, объединенные по принципу контроля последовательных метаболических реакций. У M. jannaschii такие гены могут быть случайным образом распределены по геному.
Итак, несмотря на то что архебактерии образуют особое царство и по ряду своих генетических свойств приближаются к эукариотам, размер их генома и набор основных генов остаются типичными для свободно живущих бактерий.