Топоизомеразы контролируют в клетках уровень суперскрученности ДНК, который может изменяться в процессе ее репликации, транскрипции, гомологичной рекомбинации, а также во время перестроек хроматина. Все эти ферменты релаксируют суперскрученные молекулы ДНК, снимая их внутреннее напряжение путем внесения одно- или двухцепочечных разрывов с последующим их восстановлением (лигированием). По механизму действия различают ДНК-топоизомеразы типа I и II. ДНК-топоизомеразы I, которые являются мономерными белками,
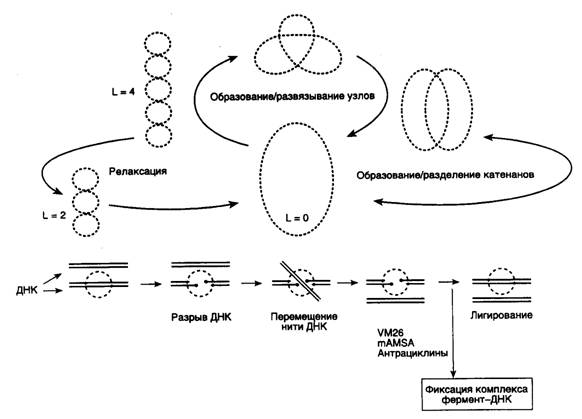
Рис. I.3. Основные этапы каталитического цикла топоизомеразы II
Внизу изображен механизм переноса нити ДНК через двухцепочечный разрыв. Точками отмечены места ковалентного присоединения фермента к 5'-концам ДНК в двухцепочечных разрывах. VM26, mAMSA, антрациклины – ингибиторы топоизомеразы II, фиксирующие ковалентный комплекс фермент-ДНК и предотвращающие лигирование двухцепочечного разрыва; L – число зацеплений ДНК в суперскрученной молекуле.
релаксируют ДНК без затраты энергии путем внесения одноцепочечных разрывов. В отличие от этого, ДНК-топоизомеразы II функционируют в виде димеров, осуществляя ATP-зависимое расщепление обеих цепей ДНК с последующим переносом цепей через разрыв и его лигированием (рис. I.3).
Для внесения одноцепочечного разрыва в ДНК все ДНК-топоизомеразы используют остаток Tyr, который осуществляет нуклеофильную атаку фосфатной группы ДНК с образованием фосфотирозина. В результате ферменты оказываются ковалентно связанными с 5'- или 3'-концами ДНК в одноцепочечном разрыве. Образование такой ковалентной связи исключает необходимость затраты энергии при восстановлении фосфодиэфирной связи в одноцепочечном разрыве на заключительных стадиях реакции. У ДНК-топоизомераз типа I имеется один каталитический остаток Tyr на молекулу мономерного белка, тогда как димеры ДНК-топоизомераз II содержат по одному каталитическому остатку на каждую субъединицу, что обеспечивает создание ступенчатого двухцепочечного разрыва в молекуле релаксируемой ДНК.
Обнаружены, по крайней мере, два подтипа ДНК-топоизомераз I – IA и IB, которые, будучи неродственными ферментами как по первичной, так и по пространственной структурам, выполняют аналогичные функции с помощью различных механизмов. До недавнего времени ДНК-топоизомеразы IA считали исключительно прокариотическими ферментами, однако они были найдены и в клетках эукариот, включая клетки человека, и названы ДНК-топоизомеразами III.
ДНК-топоизомераза IA релаксирует ДНК, содержащие только отрицательные супервитки, работает в присутствии ионов Mg2+ и ковалентно соединяется с 5'-концами ДНК в образующихся врéменных одноцепочечных разрывах. Это сближает ДНК-топоизомеразы IA и II между собой, что было подтверждено также структурными исследованиями. В отличие от этого, ДНК-топоизомеразы IB способны релаксировать ДНК как с положительными, так и отрицательными супервитками, не требуют для своего функционирования ионов металлов и взаимодействует ковалентно с 3'-концами ДНК. ДНК-топоизомеразы IB найдены исключительно в клетках эукариот (за единственным исключением вируса вакцины).
В клетках человека ДНК-топоизомераза IB/III специфически ингибируется камптотецином (camptothecin), который в настоящее время рассматривается в качестве перспективного противоопухолевого препарата. Это соединение взаимодействует преимущественно с ковалентным комплексом топоизомераза I–ДНК, что подавляет реакцию восстановления фосфодиэфирной связи и освобождение фермента из комплекса. В результате происходит быстрое накопление двухцепочечных разрывов ДНК и вступление клеток в апоптоз.
ДНК-топоизомераза II является жизненно важным ферментом любого эукариотического организма. Кроме релаксации суперскрученных молекул ДНК она может осуществлять образование или развязывание узлов, а также образование или разделение катенанов (кольцевых замкнутых ДНК, сцепленных друг с другом). Реакции развязывания узлов и разделения катенанов являются прерогативой именно ДНК-топоизомеразы II и не выполняются ДНК-топоизомеразами I.
У дрожжей ДНК-топоизомераза II требуется для разделения катенанов сестринских хроматид хромосом в анафазе митоза и абсолютно необходима для сегрегации хромосом в мейозе, а также конденсации хроматина в процессе формирования метафазных хромосом. Выяснена важная роль ДНК-топоизомеразы II и в формировании высших уровней структуры хроматина, а именно участие фермента в образовании петель хроматина во время конденсации хромосом.
ДНК-топоизомераза II локализована в ядре и в больших количествах ассоциируется с ДНК как в интерфазных, так и метафазных ядрах. С помощью специфических антител показано, что молекулы фермента располагаются преимущественно вдоль центральной продольной оси обоих плеч хромосом у многих организмов. Такое аксиальное распределение ДНК-топоизомеразы II в хромосомах наблюдали даже после удаления из них большей части гистонов в результате многократных солевых экстракций. Специфическая локализация этого фермента в хромосомах очень показательна в свете обсуждавшихся выше петельно-доменных особенностей организации хроматина в ядрах. Создается впечатление, что ДНК-топоизомераза II находится в виде гомодимера в основании петель, взаимодействуя с MAR/SAR-последовательностями ДНК хроматина. Хотя топоизомераза II не обнаруживает строгой специфичности в отношении расщепляемых последовательностей нуклеотидов, на выбор сайтов большое влияние оказывают структурные компоненты хроматина. Показано, что in vivo существуют два класса сайтов, по которым происходит расщепление ДНК этим ферментом: одни из них локализованы в активно транскрибируемых участках хроматина, гиперчувствительных к действию нуклеаз, а другие – непосредственно в MAR/SAR-последовательностях. Ассоциация ДНК-топоизомеразы II с активно транскрибируемыми участками хроматина указывает на ее возможную важную роль в регуляции экспрессии генов, что и было продемонстрировано в недавних экспериментах. Таким образом, ДНК-топоизомераза II является одним из ключевых ферментов, необходимых для разрешения сложных топологических проблем, возникающих при изменении структуры хроматина в процессах репликации ДНК, транскрипции генов и сегрегации хромосом в митозе и мейозе. Определенные изоформы (a или b) этого фермента, по-видимому, играют важную роль в поддержании динамической структуры хроматина интерфазных и митотических хромосом.
Имеющиеся в настоящее время данные свидетельствуют о высокоупорядоченной организации генома у любого, особенно эукариотического, организма. Первым уровнем такой упорядоченности является консервативное линейное распределение генов и других последовательностей нуклеотидов вдоль молекул ДНК хромосом, которое служит важным таксономическим признаком. Другим не менее жизненно важным свойством генома эукариот и, по-видимому, таксономическим признаком является его упорядоченное распределение в объеме интерфазных ядер. Высокоспецифическое пространственное распределение хроматина эукариот в интерфазных ядрах можно рассматривать в качестве второго уровня его упорядоченности. Находясь в деконденсированном состоянии после завершения митоза, интерфазные хромосомы не перемешиваются внутри интерфазных ядер, но занимают вполне определенные микрокомпартменты. Определенные участки хромосом, маркированные специфическими (в частности MAR/SAR) последовательностями, служат для прикрепления ДНК хромосом к компонентам ядерного матрикса и ядерных мембран. Такие контакты необходимы для эффективной реализации генетической информации в процессе экспрессии генов, эффективной конденсации хроматина и разделения хромосом в митозе и мейозе. Кроме того, пространственно организованное распределение генетического материала в интерфазных ядрах обеспечивает дифференциальную защиту от мутаций отдельных генетических локусов и, по-видимому, может контролировать темп и направление эволюционных изменений как отдельных локусов, так и организмов в целом (подробнее см. раздел 5.3). К сожалению, исследование пространственной организации генома в интерфазных ядрах (архитектоники ядра) сопряжено с большими методическими трудностями и сегодня еще только начинается.