| Фактор (GTF) | Молекулярные массы субъединиц (кДа) и их обозначение | Характеристика |
| TFIIA | 37 (a) 19 (b) 13 (g) | Требуются для активации транскрипции, стабилизируют взаимодействие TBP с TATA-боксом, а также TAF с ДНК, необходимы для активации некоторых промоторов |
| TFIIB | Стабилизирует комплекс Pol II/TFIIF на промоторе, обеспечивает выбор точки инициации транскрипции, претерпевает конформационные изменения под действием белков-активаторов | |
| TFIID | 38 (TBP) 250 (TAFII250) 150 (TAFII150) 135 (TAFII135) 95 (TAFII95) 80 (TAFII80) 55 (TAFII55) 31 (TAFII31) 28 (TAFII28) 20 (TAFII20) | Узнает ТАТА-последовательность, является мишенью для белков-трансактиваторов транскрипции Сериновая протеинкиназа, узнает HMG-бокс Узнает 3’-концевые области промотора Гомолог гистона H4 Гомолог гистона H3 Гомолог гистона H2B |
Таблица 1.4 (окончание)
| Фактор (GTF) | Молекулярные массы субъединиц (кДа) и их обозначение | Характеристика | ||
| TFIIE | Ассоциированы с Pol II (другое название – RAP), обладают Zn-связывающими доменами, обе субъединицы участвуют в плавлении промотора, обеспечивают вхождение TFIIH в прединициационный комплекс | |||
| TFIIF | 58 (RAP74) 26 (RAP30) | Стимулирует элонгацию, фосфорилируется in vivo Гомолог s-фактора РНК-полимеразы E. coli, предотвращает неспецифическую инициацию транскрипции | ||
| TFIIH | 89 (ERCC3) 80 (ERCC2) 62 (p62) 44 (hSSL1) 40 (cdk7) 37 (циклин H) 34 (p34) 32 (MAT-1) | 3’®5’-Хеликаза, необходимая для транскрипции; участвует в эксцизионной репарации ДНК 5’®3’-Хеликаза, необходимая для транскрипции; участвует в эксцизионной репарации ДНК Участвует в эксцизионной репарации ДНК Содержит Zn-связывающий домен, участвует в эксцизионной репарации ДНК Киназа С-концевого домена Pol II (CTD-киназа), компонент cdk7-активирующей киназы (CAK) Содержит Zn-связывающий домен, гомологичный hSSL1 Содержит Zn-связывающий домен; фактор сборки CAK | ||
| TFII I | Связывает INR-элемент (инициатор), облегчает связывание TBP | |||
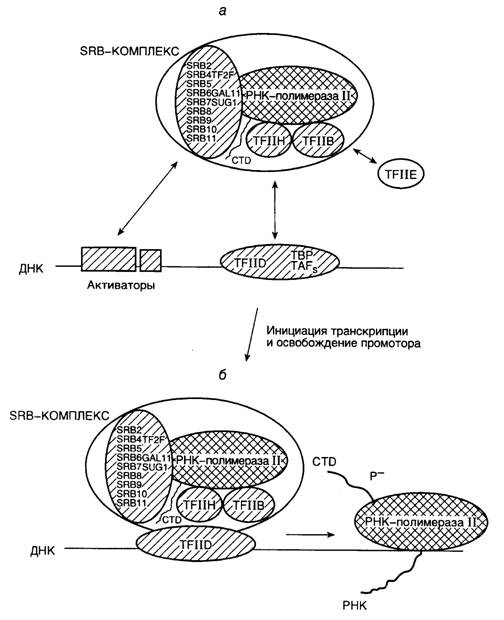
Рис. I.7. Схема инициации транскрипции РНК-полимеразой II и освобождения промотора
а – сборка прединициационного транскрипционного комплекса; б – инициация транскрипции и освобождение промотора
Ко второму классу относятся факторы транскрипции, специфически взаимодействующие с определенными последовательностями ДНК, которые являются основными регуляторами транскрипции и обеспечивают тканеспецифическую экспрессию генов. И, наконец, третий класс факторов транскрипции (в том числе многочисленные TAF-белки (TAB-associated factors)) представлен недавно открытыми белками – коактиваторами транскрипции, которые действуют согласованно с основными и тканеспецифическими факторами, обеспечивая более тонкую регуляцию транскрипции. О двух последних классах факторов транскрипции речь пойдет в разделе 3.2.2.
Первым с TATA-последовательностью промотора взаимодействует белковый комплекс TFIID (transcription factor II D), в состав которого входят белок, связывающий TATA-последовательность (TBP), а также еще по меньшей мере девять белковых субъединиц (см. рис. I.7, а). Белок TBP необходим и для осуществления транскрипции РНК-полимеразами I и III, он является универсальным фактором транскрипции у эукариот. Взаимодействие TBP с TATA-последовательностью характеризуется значительным изменением структуры ДНК в этом месте, сопровождаемым частичным разворачиванием двойной спирали. После взаимодействия с TATA-последовательностью TFIID приобретает способность ассоциироваться с факторами TFIIA и TFIIB. Присутствие TFIIB делает возможным вхождение РНК-полимеразы II в прединициационный комплекс. Присоединение РНК-полимеразы II к комплексу сопровождается связыванием с ней дополнительных факторов TFIIE, TFIIF, TFIIH и TFIIJ, что завершается образованием так называемого закрытого прединициационного комплекса (см. рис. I.7, б). Свое название комплекс получил благодаря тому, что участок ДНК промотора, входящий в его состав, в основном сохраняет свою исходную вторичную структуру – обе цепи ДНК связаны друг с другом водородными связями. В инициационном комплексе происходит локальное плавление, т.е. раскрытие соответствующего участка ДНК, и комплекс становится способным к инициации транскрипции. Аминокислотные последовательности отдельных субъединиц факторов TFIIB, TFIIE и TFIIF обнаруживают явную гомологию с последовательностями s70-фактора РНК-полимеразы E. coli. Это может указывать на определенную общность функций и эволюционного происхождения про- и эукариотических факторов транскрипции.
После сборки прединициационный закрытый комплекс претерпевает температурно-зависимые конформационные изменения, что необходимо для образования активного инициирующего транскрипционного комплекса. Показано, что в закрытом комплексе холофермент РНК-полимеразы E. coli взаимодействует с молекулой ДНК лишь с одной ее стороны, тогда как в промежуточном и открытом комплексах b- и b‘-субъединицы РНК-полимеразы полностью охватывают молекулу ДНК в окрестностях точки инициации транскрипции. Конформационный переход промежуточного прединициационного комплекса в открытый сопровождается локальным плавлением двойной спирали ДНК между нуклеотидами в положениях -10 и +3 с образованием коротких одноцепочечных участков ДНК. При наличии открытого инициационного комплекса в присутствии четырех рибонуклеозидтрифосфатов может происходить инициация транскрипции, сопровождаемая синтезом коротких (до 7–8 нуклеотидов) олигорибонуклеотидов, непрерывно освобождающихся из транскрипционного комплекса в том случае, если синтез РНК не может быть продолжен (например из-за отсутствия очередного нуклеотида). Эта стадия синтеза РНК получила название абортивной транскрипции. После синтеза РНК длиной более девяти нуклеотидов фермент покидает промотор, у РНК-полимеразы E. coli происходит отделение s-фактора от инициационного комплекса, формируется стабильный элонгирующий комплекс, и реакция транскрипции вступает в фазу элонгации.
Фаза абортивной транскрипции характерна для прокариотических и эукариотических РНК-полимераз. Однако переход от стадии абортивной транскрипции к продуктивной элонгации у эукариот характеризуется рядом особенностей. В отличие от РНК-полимеразы E. coli (а также эукариотических РНК-полимераз I и III), РНК-полимераза II содержит в С-концевом домене большой субъединицы гексапептидный повтор (до 52 повторяющихся последовательностей) CTD (carboxy terminal domain), который является субстратом протеинкиназы. В прединициационном комплексе эта последовательность аминокислотных остатков частично фосфорилирована, тогда как у активно элонгирующей РНК-полимеразы CTD фосфорилирован полностью по остаткам Ser и Thr. Несмотря на то, что in vitro многие протеинкиназы обладают способностью фосфорилировать CTD, биологические функции в данном процессе приписывают протеинкиназе фактора TFIIH. Дополнительные исследования показали, что эта протеинкиназа идентична киназе cdk7, участвующей в регуляции клеточного цикла. Предполагается, что in vivo частичное фосфорилирование CTD-домена удерживает молекулу РНК-полимеразы II на промоторе, и его полное фосфорилирование необходимо для того, чтобы фермент покинул промотор и перешел к элонгации вновь синтезируемых цепей РНК. Этот процесс получил название " освобождение промотора" (promoter clearance (escape)) (см. рис. I.7, б). Кроме того, переход закрытого прединициационного комплекса, образованного РНК-полимеразой II, в открытый инициационный комплекс является ATP-зависимым процессом.
В заключение необходимо еще раз вспомнить о том, что многие клеточные белки могут выполнять более одной функции, что является основой тесного сопряжения биохимических реакций, вовлеченных в процессы реализации генетической информации. В частности, многие (пять из девяти) субъединицы TFIIH служат основными компонентами системы эксцизионной репарации ДНК (см. табл. I.4, а также раздел 5.2.2). Такое сопряжение приводит к более эффективной репарации повреждений ДНК в активно транскрибируемых генах по сравнению с молчащими последовательностями ДНК.
Элонгация цепей РНК. Момент перехода РНК-полимеразы от инициации транскрипции к элонгации точно не определен. Три основных биохимических события характеризуют этот переход в случае РНК-полимеразы E. coli: отделение s-фактора, первая транслокация молекулы фермента вдоль матрицы и сильная стабилизация транскрипционного комплекса, который кроме РНК-полимеразы включает растущую цепь РНК и транскрибируемую ДНК. Все те же явления характерны и для РНК-полимераз эукариот, хотя в этом случае момент перехода от инициации к элонгации еще более неопределенен. И в том, и в другом случае переход от инициации к элонгации сопровождается разрывом связей между ферментом, промотором, факторами инициации транскрипции, а в ряде случаев – переходом РНК-полимеразы в состояние компетентности в отношении элонгации (например фосфорилирование CTD-домена у РНК-полимеразы II). Фаза элонгации заканчивается после освобождения растущего транскрипта и диссоциации фермента от матрицы (терминация).
Биохимические особенности элонгации. РНК-полимеразы являются процессивными ферментами: если фермент освобождает растущую цепь РНК до завершения транскрипции гена, то он не в состоянии связать эту РНК вновь и продолжить транскрипцию. Поэтому каждый новый раунд синтеза РНК начинается с реинициации транскрипции на промоторе. Такие биохимические особенности РНК-полимераз объясняют, почему стабильность транскрибирующего комплекса является одним из его критических свойств.
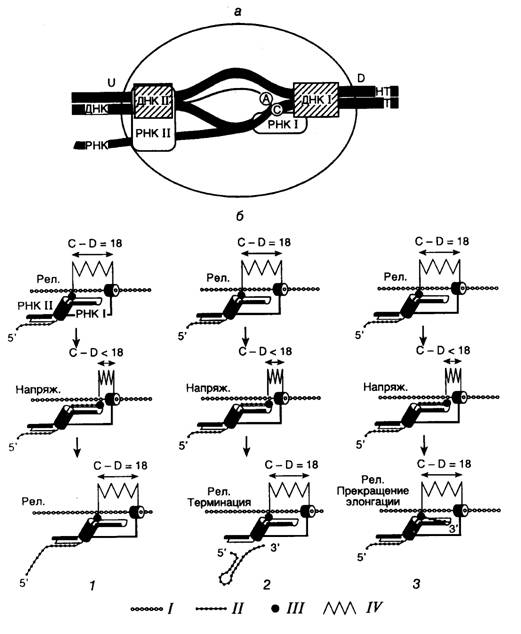
Рис. I.8. Модели структуры тройного комплекса элонгирующей РНК-полимеразы E. coli (а) и механизма скачкообразной элонгации (б)
а: Т и НТ – соответственно транскрибируемая и нетранскрибируемая цепи ДНК. ДНК I и ДНК II, РНК I и РНК II – сайты связывания соответственно ДНК и РНК, А – активный центр, D и U – соответственно передняя и задняя части движущегося фермента, С – 3¢-конец РНК.
б: Цикл скачкообразной элонгации транскрипции (1), сопровождаемой терминацией синтеза РНК (2) или образованием комплексов полностью прекративших элонгацию (3). I и II – соответственно транскрибируемая цепь ДНК и строящаяся цепь РНК; III – активный центр фермента; IV – напряженное (напряж.) и релаксированное (рел.) состояния полипептидной цепи РНК-полимеразы; цилиндр, охватывающий цепь ДНК – ДНК-связывающий центр I; С–D – расстояние между 3¢-концом РНК и передней границей РНК-полимеразы (п.о.)
Действительно, многие гены эукариот обладают очень большими размерами (длина гена дистрофина человека, например превышает 2000 т.п.о. и его транскрипция продолжается ~ 17 ч), следовательно, преждевременная терминация транскрипции могла бы с большой вероятностью прекратить экспрессию таких генов вообще. Из этих соображений не удивительно, что тройной комплекс РНК-полимераза–РНК–матрица чрезвычайно стабилен. Такие комплексы устойчивы к высокой ионной силе, допускают очистку гель-фильтрацией, преципитацию антителами, остаются активными после проведения электрофореза в неденатурирующих условиях и могут храниться в отсутствие рибонуклеозидтрифосфатов при +4оС в течение нескольких дней без потери активности.
В настоящее время разработаны методы, позволяющие задерживать элонгирующую РНК-полимеразу бактерий в любом участке матрицы путем удаления из реакционной смеси одного из рибонуклеозидтрифосфатов. При таком подходе РНК-полимеразу иммобилизуют на носителе, и процесс транскрипции осуществляют непосредственно в колонке, последовательно добавляя нуклеотид за нуклеотидом после отмывания предыдущего. Это дает возможность последовательно перемещать РНК-полимеразу от одного нуклеотида к другому вдоль матрицы, как бы шагать вдоль матричной ДНК (walking). Такой метод является прекрасным инструментом для исследования механизмов элонгации и обнаружения факторов транскрипции, оказывающих влияние на этот процесс.
Скорости транскрипции матричной ДНК РНК-полимеразами сильно различаются. Обнаружена слабая корреляция между субъединичным строением РНК-полимераз и скоростью, с которой они способны элонгировать ДНК. Так, РНК-полимеразы бактериофагов, состоящие из одной субъединицы, являются наиболее быстрыми среди ДНК-зависимых РНК-полимераз. Они способны элонгировать in vitro растущую цепь РНК со скоростью 200–400 нт/с. Бактериальные РНК-полимеразы транскрибируют ДНК с промежуточной скоростью – 50–100 нт/с, тогда как скорость элонгации РНК-полимеразой II многоклеточных организмов in vitro составляет всего 5–10 нт/с. Эукариотические РНК-полимеразы элонгируют цепи РНК in vivo со скоростью ~20–30 нт/с.
Точность транскрипции, осуществляемой РНК-полимеразами, ниже соответствующего параметра ДНК-полимераз. Частота ошибок в виде включенных в РНК некомплементарных матрице нуклеотидов составляет 10-3–10-5. Это объясняется, прежде всего, тем, что РНК-полимеразы лишены корректирующей системы в виде 3’®5’- и 5’®3’-экзонуклеазной активности. В определенных условиях РНК-полимеразы обладают способностью отщеплять 3’-концевую часть транскрипта, находящегося в составе тройного комплекса (см. ниже). Однако до сих пор не ясно, имеет ли эта активность отношение к коррекции ошибок. С эволюционной точки зрения понятно, почему точность транскрипции в меньшей степени подвержена давлению отбора по сравнению с точностью репликации. Действительно, если ошибки репликации должны сопровождаться изменением генотипа клетки или организма, то ошибки транскрипции не приводят к таким последствиям.
Структура элонгирующего комплекса. Основные черты структуры тройного комплекса, осуществляющего элонгацию цепей РНК, консервативны у всех ДНК-зависимых РНК-полимераз (см. рис. I.8). В каждом элонгирующем комплексе имеются каталитический центр, одноцепочечная область ДНК-матрицы, а также несколько сайтов связывания ДНК и РНК. Для реализации принципа комплементарности при построении растущей цепи РНК участок матричной ДНК, входящий в состав комплекса, находится в расплавленном состоянии, и одна из его цепей служит матрицей при транскрипции. Этот участок ДНК, называемый транскрипционным пузырьком, или транскрипционной сферой (transcription bubble), контактирует с каталитическим центром РНК-полимеразы. По обеим сторонам транскрипционного пузырька имеются участки ДНК, которые при перемещении фермента вдоль матрицы подвергаются плавлению (расплетанию) и повторному отжигу, в результате которого восстанавливается исходная структура ДНК. Считается, что этот процесс не является каталитическим, протекает самопроизвольно и связан с особенностями структуры РНК-полимеразы как таковой.
В молекуле РНК-полимеразы имеются несколько участков связывания матричной ДНК и участок связывания растущей цепи РНК, которые обеспечивают точное расположение 3’-ОН-конца РНК относительно транскрибируемого в данный момент нуклеотида матрицы и соответствующего субстрата. В ранних моделях элонгирующего комплекса постулировалось существование короткого гибрида между матричной ДНК и строящейся цепью РНК, однако в настоящее время эта модель подвергается сомнению. Считается, что если гибрид существует, то его длина составляет лишь 2–12 п.о. Современные модели элонгирующего комплекса предполагают наличие механизма, обеспечивающего выбор правильного нуклеотида из пула субстратов. Хотя в принципе этот процесс может быть исключительно следствием комплементарного взаимодействия нуклеотида и матрицы, более распространена точка зрения, согласно которой ключевую роль здесь играет сама молекула РНК-полимеразы, пространственная структура которой формируется при ее контакте с ДНК и растущим транскриптом.
В современных моделях структуры элонгирующего комплекса предполагают наличие в РНК-полимеразе двух сайтов, удерживающих растущую цепь РНК, и двух участков связывания ДНК-матрицы. В совокупности эти участки связывания обеспечивают замечательную стабильность комплекса. Тем не менее, точное положение этих сайтов связывания нуклеиновых кислот в настоящее время неизвестно. Для РНК-полимеразы E. coli имеются доказательства того, что задняя часть элонгирующего фермента контактирует с двухцепочечной ДНК, а передняя – с одноцепочечной, причем с ее транскрибируемой (матричной) цепью.
Способы блокировки элонгации растущих цепей РНК. Элонгация РНК не происходит с постоянной скоростью. Во время элонгации РНК-полимераза может получать сигналы, вызывающие задержку транскрипции (pause), ее прекращение (arrest), или терминацию. В результате задержки молекула РНК-полимеразы временно останавливает синтез РНК на определенный период времени, после чего спонтанно продолжает транскрипцию. В отличие от этого, элонгирующие комплексы, прекратившие синтез РНК, неспособны продолжить транскрипцию без помощи дополнительных факторов. Сигналы, вызывающие такое поведение РНК-полимеразы, могут быть внутренними, в виде определенной последовательности нуклеотидов транскрибируемой ДНК, или внешними – в виде специфических белков-регуляторов, связавшихся с матрицей. Прекращение транскрипции может быть вызвано и в искусственных условиях при отсутствии одного или нескольких рибонуклеозидтрифосфатов. Как во время задержки, так и во время прекращения синтеза РНК РНК-полимераза остается каталитически активной, стабильно связанной с ДНК и удерживает растущий транскрипт в составе тройного комплекса. Именно эти характерные особенности отличают РНК-полимеразу в состоянии задержки или прекращения синтеза РНК от фермента, находящегося в фазе терминации транскрипции. Во многих случаях, когда невозможно четко дифференцировать три вышеупомянутых состояния транскрипции, говорят просто о блокировке синтеза РНК.
Как остановка, так и прекращение синтеза РНК характеризуются двумя параметрами – временем полужизни блокированного состояния комплекса и эффективностью распознавания сигнала. Под временем полужизни блокировки элонгации понимают промежуток времени, за который половина блокированных молекул РНК-полимеразы вступает в фазу продолжения синтеза РНК. Остановка может быть настолько кратковременной, что время полужизни блокированного комплекса невозможно точно определить; в то же время задержка элонгации может продолжаться в течение нескольких минут, что зависит от локализации и структуры соответствующего сайта на матричной ДНК. Эффективность распознавания сигнала блокировки определяется долей молекул РНК-полимеразы, отвечающих прекращением элонгации на соответствующем сайте, и может принимать значения от нескольких до 90%. Описано несколько сайтов, обладающих эффективностью 100%.
Временные остановки элонгирующей РНК-полимеразы на транскрибируемой ДНК бактериофага Т7 были обнаружены в бесклеточных системах, синхронизированных в отношении инициации синтеза РНК. Неожиданно оказалось, что молекулы РНК-полимеразы, синхронно инициировавшие транскрипцию с одного промотора, быстро и специфически распределяются в составе тройного комплекса вдоль матрицы, оставаясь ассоциированными с растущими цепями РНК дискретной длины. Исследование этого феномена привело к заключению о временных остановках РНК-полимеразы во время транскрипции в определенных участках матрицы и было одним из первых доказательств того, что синтез РНК не является непрерывным процессом. Такие врéменные задержки во время элонгации характерны для многих РНК-полимераз, включая РНК-полимеразы I, II и III эукариотических организмов.Как у прокариот, так и у эукариот имеются многочисленные механизмы, регулирующие эффективность задержки транскрипции в определенных сайтах транскрибируемой ДНК (подробнее см. раздел 3.2).
В отличие от описанной выше врéменной задержки транскрипции, полное прекращение элонгации РНК внутри транскрибируемого гена физически блокирует перемещение вдоль гена других молекул РНК-полимеразы, инициировавших транскрипцию на тех же промоторах. Следствием этого является полное прекращение транскрипции такого гена, что служит одним из распространенных механизмов регуляции экспрессии генов на уровне элонгации РНК. Состояние прекращения элонгации РНК-полимеразой может возникать на некоторых участках матрицы in vitro в отсутствие одного или нескольких рибонуклеозидтрифосфатов. В этом случае, в отличие от временной задержки транскрипции, добавление в бесклеточную систему недостающих нуклеотидов не приводит к возобновлению синтеза РНК. Большинство тройных комплексов, прекративших транскрипцию по такому механизму, являются стабильными, а входящая в их состав РНК-полимераза полностью сохраняет свою активность. Переход элонгирующих комплексов из состояния врéменной задержки в состояние полного прекращения транскрипции происходит постепенно, по мере увеличения времени инкубации бесклеточной системы в отсутствие субстратов. В настоящее время не существует прямых доказательств наличия феномена полного прекращения элонгации in vivo. Однако по ряду косвенных данных, включая открытие белков, реактивирующих такие тройные комплексы, считается, что полное прекращение транскрипции имеет место также в клетках живого организма и является одним из регуляторных механизмов, координирующих экспрессию генов на уровне транскрипции.Задержка и полное прекращение транскрипции во время элонгации цепей РНК становятся возможными благодаря взаимодействиям между РНК-полимеразой, растущей цепью РНК и транскрибируемой ДНК и не требуют участия дополнительных факторов.Несмотря на интенсивные исследования, до сих пор не удается предсказывать места задержки элонгации РНК на матричных ДНК.
Природа сигналов, обеспечивающих задержку элонгирующих тройных комплексов у прокариот. Сигналы, вызывающие задержку элонгации, многокомпонентны. Они включают элементы как РНК, так и ДНК. Во многих сайтах задержки элонгации РНК-полимераза синтезирует участок РНК, который имеет склонность образовывать стабильную вторичную структуру. В этом случае мутации, разрушающие шпильку, уменьшают время полужизни комплекса в состоянии задержки элонгации. И наоборот, мутации, восстанавливающие вторичную структуру, увеличивают время полужизни таких комплексов. Это указывает на то, что сама вторичная структура, а не конкретная последовательность нуклеотидов внутри шпильки существенна для задержки элонгации растущей цепи РНК. В пользу этого вывода свидетельствует и тот факт, что включение в РНК IMP вместо GMP, приводящее к снижению числа водородных связей в шпильках, а следовательно, и их прочности, приводит к элиминации некоторых мест задержки элонгации. Тем не менее, образование шпильки в РНК еще не является достаточным условием задержки транскрипции в соответствующем участке матрицы, так как многие места задержки не содержат таких последовательностей. Последовательности ДНК и РНК, расположенные между основанием шпильки и активным центром РНК-полимеразы, также оказывают влияние на задержку элонгации. Замены нуклеотидов в 3'-концевых частях таких последовательностей сопровождаются изменениями времени полужизни комплекса в состоянии задержки. Полагают, что в этом случае вторичная структура РНК не имеет отношения к наблюдаемым эффектам.
Сигналы задержки элонгации могут действовать не только через РНК, но и на уровне ДНК. Так, последовательности, расположенные даже на 17 нуклеотидов ниже участка задержки транскрипции, оказывают влияние на задержку. Полагают, что одной из причин этого может быть воздействие таких последовательностей на способность РНК-полимеразы создавать локально расплетенный участок матричной ДНК. Альтернативным объяснением является влияние таких участков матричной ДНК на конформацию РНК-полимеразы. В случае РНК-полимеразы E. coli эти участки ДНК находятся в контакте с ферментом в одном из его ДНК-связывающих сайтов. С помощью мутационного анализа было установлено, что на задержку элонгации могут оказывать влияние и последовательности нуклеотидов нематричной цепи ДНК.
Природа прокариотических сигналов, вызывающих прекращение элонгации РНК. Так же как и в предыдущем случае, природа сигналов, вызывающих прекращение элонгации, не вполне ясна. В окрестностях сайтов на ДНК, вызывающих прекращение элонгации, не обнаружено каких-либо канонических последовательностей. К этому феномену может быть причастна вторичная структура РНК, поскольку замещение GMP на IMP, приводящее к ослаблению вторичной структуры РНК, во многих случаях предотвращает прекращение транскрипции в соответствующих участках ДНК. Большинство элонгирующих комплексов, прекративших транскрипцию, было получено в искусственных условиях при недостатке рибонуклеозидтрифосфатов. В отличие от сигналов задержки транскрипции, ни один из сигналов прекращения транскрипции не был обнаружен внутри прокариотических генов.
Сигналы остановки транскрипции на уровне элонгации у эукариот. Участки ДНК, вызывающие задержку и прекращение элонгации у эукариот, охарактеризованы слабо. Имеются данные, что в случае РНК-полимераз I и II такие участки ДНК часто содержат Т-богатые последовательности в нематричной цепи, однако это не является общим правилом. Если такие Т-богатые участки существуют, то в них часто происходит формирование изгиба ДНК, а эффективность блока прямо пропорциональна длине Т-богатой последовательности. Наличие шпилек в транскриптах этих участков не всегда требуется для блокировки транскрипции. В случае РНК-полимеразы II существенным моментом блокировки является взаимодействие каталитического сайта фермента с ниже расположенными последовательностями ДНК. При этом задержанный комплекс с течением времени может превращаться в комплекс, полностью прекративший транскрипцию. Эффективность распознавания РНК-полимеразой участков задержки на ДНК зависит от свойств промотора, на котором произошла инициация транскрипции, а также расстояния сайта блокировки от промотора. Как у прокариот, так и у эукариот специфические белки оказывают сильное влияние на способность РНК-полимеразы распознавать участки задержки и прекращения транскрипции. Многие из этих белков участвуют в регуляции транскрипции на уровне элонгации.
Внешние факторы, блокирующие элонгацию цепей РНК. В дополнение к только что рассмотренным внутренним сигналам, препятствующим элонгации РНК, существует большое число внешних факторов, оказывающих влияние на этот процесс. Имеется много примеров, когда ДНК-связывающие белки блокируют элонгацию цепей РНК вирусными, прокариотическими и эукариотическими РНК-полимеразами как в природных условиях, так и в бесклеточных системах. Однако во многих случаях РНК-полимеразы способны обходить ДНК-связывающие белки без задержки транскрипции. Хотя белки являются основным препятствием на пути элонгации РНК, имеются и другие факторы, оказывающие подобное влияние на элонгацию. В частности, показано, что интенсивное негативное и позитивное суперскручивание ДНК-матрицы может увеличивать время полужизни элонгирующих комплексов в задержанном состоянии. ДНК в Z-форме также может ингибировать элонгацию. Многие вещества, взаимодействующие с ДНК, а также повреждения ДНК ингибируют элонгацию. Интересно, что РНК-полимераза E. coli способна преодолевать участки ДНК с отсутствующими азотистыми основаниями. Еще более удивительной является способность Т7-РНК-полимеразы не замечать короткие бреши в матричной цепи ДНК длиной в 1–5 нуклеотидов. Она может перебираться через бреши даже длиной в 24 нуклеотида, хотя и с меньшей эффективностью. Прохождение РНК-полимеразы через такие бреши сопровождается образованием единого транскрипта, содержащего делецию в соответствующем участке РНК. Способность РНК-полимеразы транскрибировать ДНК, содержащие бреши, зависит от природы 3’-концевого нуклеотида, после которого начинается брешь: 3’-ОН-конец допускает транскрипцию, тогда как 3’-фосфат блокирует элонгацию.
Расщепление транскрипта в комплексах, полностью прекративших элонгацию. РНК-полимеразы в составе тройных комплексов, включая все три РНК-полимеразы эукариот и РНК-полимеразу E. coli, способны осуществлять эндонуклеазное расщепление растущей цепи РНК вблизи ее 3’-конца. Образующийся в результате более протяженный 5’-концевой фрагмент РНК остается прочно связанным с ферментом, тогда как 3’-концевой фрагмент освобождается из тройного комплекса. При этом каталитический центр РНК-полимеразы остается правильно ориентированным в отношении оставшегося транскрипта и ДНК-матрицы, и она способна продолжать транскрипцию, не образуя в синтезируемой РНК внутренних делеций. Реакция расщепления не является пирофосфоролизом, поскольку в результате пирофосфоролиза формируется фрагмент РНК, содержащий 5’-концевой нуклеозидтрифосфат, а при расщеплении транскрипта РНК-полимеразой образуется фрагмент РНК с монофосфатом на 5'-конце. Белки E. coli GreA и GreB, а также эукариотический фактор транскрипции TFIIS стимулируют процесс расщепления. Те же факторы и, кроме того, состав тройного комплекса оказывают влияние на размер освобождающегося в процессе расщепления 3’-концевого фрагмента РНК, который может варьировать от 1 до 17 нуклеотидов. В разных тройных комплексах процесс расщепления может происходить мгновенно или растягиваться на несколько часов. Полагают, что кинетика этого процесса зависит от конформации тройного комплекса, которая может быть различной в разных участках матричной ДНК.
Имеются доказательства того, что расщепление транскрипта катализируется одним активным центром фермента, ответственным, кроме того, за полимеризацию рибонуклеозидтрифосфатов и пирофосфоролиз РНК. В частности, было показано, что неорганический пирофосфат может индуцировать освобождение олигонуклеотидного фрагмента РНК, содержащего 5’-концевую трифосфатную группу, из тройного комплекса, прекратившего синтез РНК. Эти данные интерпретируются в пользу того, что активный центр РНК-полимеразы, прекратившей транскрипцию, смещается от 3’-конца элонгируемого транскрипта к его 5’-концу, где он и катализирует пирофосфоролитическое расщепление РНК. Кроме того, до настоящего времени не обнаружено ингибиторов расщепления транскрипта, которые одновременно не подавляли бы самого синтеза РНК. Не найдено и мутантов, у которых оба этих процесса были бы разделены. И, наконец, расщепление транскрипта и полимеризация субстратов происходят в одинаковых условиях: в присутствии двухвалентных катионов с одним и тем же оптимумом рН реакционной смеси.
Физиологическое значение реакции расщепления транскрипта РНК-полимеразой еще предстоит выяснить. Известно, что факторы GreA и TFIIS, которые стимулируют расщепление РНК, одновременно подавляют образование прекративших транскрипцию комплексов. В соответствии с наиболее распространенной точкой зрения расщепление транскрипта помогает РНК-полимеразе выйти из состояния полного прекращения транскрипции. Полагают, что в тройном комплексе, прекратившем транскрипцию, активный центр РНК-полимеразы постепенно смещается от 3’-конца РНК к 5’-концу и утрачивает способность ее элонгировать. Эндонуклеазное расщепление транскрипта правильно ориентирует новый 3’-концевой нуклеотид РНК относительно активного центра РНК-полимеразы, что реактивирует процесс транскрипции. Другой возможной функцией расщепления РНК молекулой РНК-полимеразы может быть коррекция ошибочно включенных в растущую РНК 3’-концевых нуклеотидов.Если после включения некомплементарного матрице нуклеотида в РНК молекула РНК-полимеразы делает паузу в элонгации, то вырезание 3’-концевого фрагмента растущей цепи РНК и продолжение элонгации можно рассматривать как имитацию РНК-полимеразой хорошо известной 3’®5’-экзонуклеазной корректирующей активности ДНК-полимеразы I E. coli. Такой механизм может помогать РНК-полимеразе в преодолении физических препятствий во время транслокации. Известно, что места задержки транскрибирующей РНК-полимеразы на ДНК распознаются молекулами фермента, находящимися в определенной фазе (рамке считывания) по отношению к этим сайтам. Поскольку отщепление 3’-концевого участка ДНК и обратная транслокация могут перевести фермент в новую фазу по отношению к сайтам задержки на ДНК, то фермент, начиная транскрипцию из нового положения, сможет беспрепятственно преодолевать сайты задержки в процессе элонгации. Одним из таких преодолеваемых при транскрипции барьеров для РНК-полимеразы у эукариот могут быть, в частности нуклеосомы.
Помимо всего прочего, в настоящее время показано, что вышеупомянутые факторы GreA и GreB стимулируют процесс освобождения промоторов бактериальными РНК-полимеразами.
Реитеративный синтез гомополимеров. Молекулы РНК, обычно синтезируемые РНК-полимеразами, строго комплементарны транскрибируемым участкам матричной РНК. Однако в редких случаях in vivo, а также в определенных искусственных условиях РНК-полимеразы способны осуществлять так называемый реитеративный синтез гомополимеров, во время которого молекула РНК-полимеразы, многократно проскальзывая вдоль короткой гомополимерной последовательности (transcriptional slippage), синтезирует длинные комплементарные этой последовательности гомополимеры – поли(А), поли(U) или поли(С). Размеры образующихся при этом гомополимерных продуктов могут более чем в 10–20 раз превышать длину матричной последовательности. Реитеративный синтез протекает особенно эффективно на одноцепочечных ДНК в присутствии ионов Mn2+ вместо Mg2+ и необходимого рибонуклеозидтрифосфата. Если же олигонуклеотидная последовательность матрицы включена в случайную последовательность, то реитеративного синтеза не происходит при наличии в реакционной смеси кроме нуклеотида, составляющего гомополимер, других рибонуклеозидтрифосфатов. Это обусловлено пребыванием тройного комплекса в состоянии обычной элонгации.
Реитеративный синтез гомополимеров РНК-полимеразами может происходить как во время инициации транскрипции, так и в фазе элонгации. При инициации РНК-полимераза может начинать реитеративный синтез при наличии в окрестностях точки инициации транскрипции гомополимера длиной в 3 и даже 2 нуклеотида. Во время элонгации РНК-полимераза предпочитает осуществлять реитеративный синтез на более длинных гомополимерных последовательностях. В частности, в двух исследованных случаях элонгирующая РНК-полимераза E. coli осуществляла реитеративный синтез поли(A) или поли(U) на последовательностях, состоящих из dT или dA, длиной в 10 нуклеотидов.
Несмотря на то что реитеративный синтез гомополимеров является редким событием in vivo, он выполняет определенные функции в регуляции транскрипции. Показано, что проскальзывание РНК-полимеразы вдоль гомополимерных последовательностей матрицы может быть механизмом, изменяющим рамки считывания мРНК при трансляции, редактирующим генетическую информацию мРНК, осуществляющим присоединение к РНК поли(А)-хвостов и 5'-концевых последовательностей к вирусным РНК, а также регулирующим инициацию транскрипции некоторых бактериальных оперонов (например pyrBI или codBA). Поскольку нерегулируемый реитеративный синтез внутри кодирующих частей генов таит большую опасность для их экспрессии, предполагают, что гомополимерные последовательности в транскрипционных единицах являются мишенью для эволюционного отбора, который их элиминирует. Действительно, компьютерный анализ под этим углом зрения последовательностей нуклеотидов E. coli показал отсутствие достаточно протяженных гомополимеров в кодирующих частях генов и их наличие в некодирующих последовательностях бактериального генома.
Современные модели структуры элонгирующих тройных комплексов и механизма элонгации растущих цепей РНК. В 1992 г. М. Ча