А5. Простые и сложные вещества. Основные классы неорганических веществ. Номенклатура неорганических соединений.
Простые и сложные вещества.
Простые вещества образованы атомами одного химического элемента (водород Н2, азот N2, железо Fe и т.д.), сложные вещества - атомами двух и более химических элементов (вода H2O – состоит из двух элементов (водород, кислород), серная кислот H2SO4 – образована атомами трёх химических элементов (водород, сера, кислород)).
Основные классы неорганических веществ, номенклатура.

Оксиды – сложные вещества, состоящие из двух элементов, один из которых кислород в степени окисления -2.
Номенклатура оксидов
Названия оксидов состоят из слов «оксид» и названия элемента в родительном падеже (с указанием в скобках степени окисления элемента римскими цифрами): CuO – оксид меди (II), N2O5 – оксид азота (V).
Характер оксидов:
| ХЭ | основный | амфотерный | несолеобразующий | кислотный |
| металл | С.О.+1,+2 | С.О.+2, +3, +4 амф. Ме – Ве, Аl, Zn, Cr, Fe, Mn | - | С.О.+5, +6, +7 |
| неметалл | - | - | С.О.+1,+2 (искл. Cl2O) | С.О.+4,+5,+6,+7 |
Основные оксиды образуют типичные металлы со С.О. +1, +2 (Li2O, MgO, СаО, CuO и др.). Основными называются оксиды, которым соответствуют основания.
Кислотные оксиды образуют неметаллы со С.О. более +2 и металлы со С.О. от +5 до +7 (SO2, SeO2, Р2O5, As2O3, СO2, SiO2, CrO3 и Mn2O7). Кислотными называются оксиды, которым соответствуют кислоты.
Амфотерные оксиды образованы амфотерными металлами со С.О. +2, +3, +4 (BeO, Cr2O3, ZnO, Al2O3, GeO2, SnO2 и РЬО). Амфотерными называются оксиды, которые проявляют химическую двойственность.
Несолеобразующие оксиды – оксиды неметаллов со С.О.+1,+2 (СО, NO, N2O, SiO).
Основания (основные гидроксиды) — сложные вещества, которые состоят из иона металла (или иона аммония) и гидроксогруппы (-OH).
|
|
Номенклатура оснований
После слова «гидроксид» указывают элемент и его степень окисления (если элемент проявляет постоянную степень окисления, то её можно не указывать):
КОН – гидроксид калия
Сr(OH)2 – гидроксид хрома (II)
Основания классифицируют:
1) по растворимости в воде основания делятся на растворимые (щелочи и NH4OH) и нерастворимые (все остальные основания);
2) по степени диссоциации основания подразделяют на сильные (щелочи) и слабые (все остальные).
3) по кислотности, т.е. по числу гидроксогрупп, способных замещаться на кислотные остатки: на однокислотные (NaOH), двухкислотные [Ca(OH)2], трехкислотные [Al(OH)3].
Кислотные гидроксиды (кислоты) - сложные вещества, которые состоят из атомов водорода и кислотного остатка.
Кислоты классифицируют:
a) по содержанию атомов кислорода в молекуле - на бескислородные (Нcl) и кислородсодержащие (H2SO4);
б) по основности, т.е. числу атомов водорода, способных замещаться на металл - на одноосновные (HCN), двухосновные (H2S) и т.д.;
в) по электролитической силе - на сильные и слабые. Наиболее употребляемыми сильными кислотами являются разбавленные водные растворы HCl, HBr, HI, HNO3, H2SO4, HClO4.
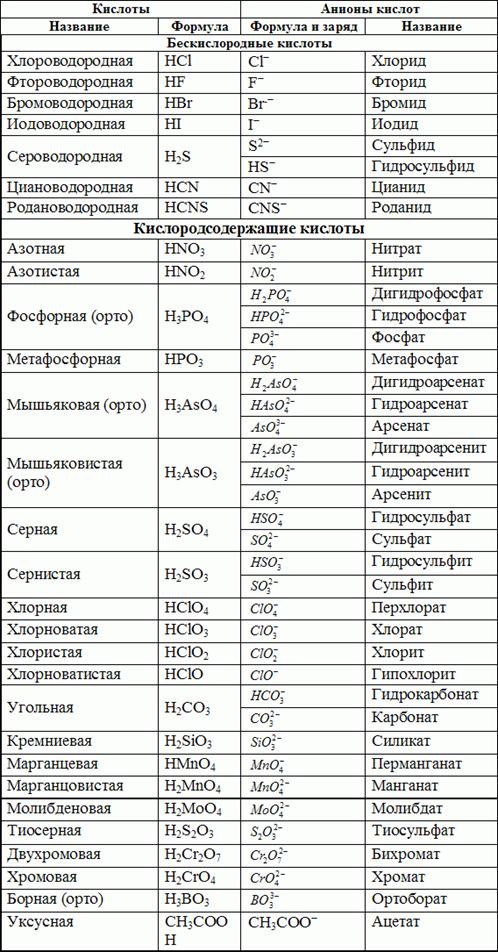
Амфотерные гидроксиды образованы элементами с амфотерными свойствами.
Соли – сложные вещества, образованные атомами металлов, соединёнными с кислотными остатками.
Средние (нормальные) соли — все атомы водорода в молекулах кислоты замещены на атомы металла.
Номенклатура средних солей
Название солей строится по следующей схеме:
|
|
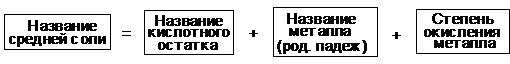
Например: Fe2S3 - сульфид железа(III).
Кислые соли — атомы водорода в кислоте замещены атомами металла частично. Они получаются при нейтрализации основания избытком кислоты. Чтобы правильно назвать кислую соль, необходимо к названию нормальной соли прибавить приставку гидро- или дигидро- в зависимости от числа атомов водорода, входящих в состав кислой соли.
Например, KHCO3 – гидрокарбонат калия, КH2PO4 – дигидроортофосфат калия
Нужно помнить, что кислые соли могут образовывать двух и более основные кислоты, как кислородсодержащие, так и бескислородные кислоты.
Основные соли — гидроксогруппы основания (OH−) частично замещены кислотными остатками. Чтобы назвать основную соль, необходимо к названию нормальной соли прибавить приставку гидроксо- или дигидроксо- в зависимости от числа ОН - групп, входящих в состав соли.
Например, (CuOH)2CO3 - гидроксокарбонат меди (II).
Нужно помнить, что основные соли способны образовывать лишь основания, содержащие в своём составе две и более гидроксогрупп.
Двойные соли — в их составе присутствует два различных катиона, получаются кристаллизацией из смешанного раствора солей с разными катионами, но одинаковыми анионами.
Смешанные соли — в их составе присутствует два различных аниона.
Гидратные соли (кристаллогидраты) — в их состав входят молекулы кристаллизационной воды. Пример: Na2SO4 ·10H2O.
Тривиальные (исторически сложившиеся) названия часто употребляемых неорганических веществ:
| Название | Химическая формула |
| Белый фосфор | P4 |
| Боксит | Al2O3· nH2O |
| Бурый газ | NO2 |
| Вода | H2O |
| Глауберова соль | Na2SO4· 10H2O |
| Доломит | CaCO3MgCO·3 |
| Закись азота (веселящий газ) | N2O |
| Едкий натр | NaOH |
| Едкое кали | KOH |
| Известковая вода (молоко) | Ca(OH)2 + H2O |
| Известняк, мел, мрамор | CaCO3 |
| Каустическая сода | NaOH |
| Кварц, кварцевый песок | SiO2 |
| Ляпис | AgNO3 |
| Нашатырный спирт | NH3 · nH2O |
| Олеум | SO3 + H2SO4 |
| Пирит, серный колчедан, железный колчедан | FeS2 |
| Поташ | K2CO3 |
| Сернистый ангидрид, сернистый газ | SO2 |
| Углекислый газ | СO2 |
|
|