Периодическая система химических элементов в короткой форме состоит из семи периодов – горизонтальных последовательностей химических элементов, расположенных по возрастанию заряда атомных ядер.
Атомы элементов одного периода имеют одинаковое число энергетических уровней (электронных слоёв), равное номеру периода и максимальному значению главного квантового числа n. Исключение составляет элемент 46Pd (палладий), атомы которого имеют четыре энергетических уровня, хотя расположен он в пятом периоде.

Каждый период (кроме первого) начинается элементом – щелочным металлом, в атомах которого на внешнем энергетическом уровне находится 1 электрон на n s -подуровне. Заканчиваются периоды элементами – благородными газами, атомы которых на внешнем уровне имеют энергетически выгодную, и поэтому устойчивую, электронную конфигурацию n s2 n p6.
Первый период начинается с элемента водорода, который в силу специфики свойств его атомов, помещают в первую и в седьмую группу. Этот период заканчивается элементом гелием, электронная конфигурация которого 1s2.
Закономерностью заполнения электронами энергетических уровней атомов объясняется различное число химических элементов в периодах, равное максимальному числу электронов на заполняемых энергетических подуровнях.
У атомов элементов первого периода заполняется единственный s -подуровень первого энергетического уровня, который имеет только одну орбиталь, и, следовательно, на нём может находиться всего 2 электрона. Поэтому первый период состоит только из двух s -элементов (H и He).
У атомов элементов второго и третьего периодов электроны могут занимать четыре орбитали: одну – s -подуровня и три – р -подуровня внешнего (соответственно второго и третьего) энергетического уровня. Поэтому второй и третий периоды состоят из двух s- и шести p -элементов.
В четвёртом и пятом периодах содержится по 18 химических элементов, так как заполняются, кроме четырёх орбиталей s - и p -подуровней внешнего (соответственно четвёртого и пятого) энергетического уровня, ещё пять орбиталей d -подуровня предвнешнего уровня, то есть (n – 1) d -подуровня. Поэтому эти периоды между s - и p -элементами содержат вставные декады переходных элементов (d -элементы).
Следующие – шестой и седьмой – периоды ещё длиннее, так как в атомах их элементов, кроме девяти орбиталей n s-, n р- и (n – 1) d -подуровней, происходит заполнение электронами семи f -орбиталей предпредвнешнего уровня, то есть (n – 2) f -подуровня.
Шестой период имеет две вставки химических элементов: вслед за 6 s -элементами расположена декада 5 d -элементов, в которой после первого элемента – лантана, находятся 14 4 f -элементов (лантаниды*). В итоге шестой период состоит из 32 химических элементов.
Аналогично построен и пока незавершённый седьмой период (25**) химических элементов), в котором за первым 6 d -элементом вставной декады – актинием, следуют 14 5 f -элементов (актиниды***).
Свойства химических элементов закономерно изменяются в периодах при переходе от щелочных металлов к благородным газам. При переходе от одного периода к последующему число внешних электронов меняется скачкообразно.
По вертикали периодическая система подразделяется на восемь групп (I–VIII), объединяющих химические элементы, атомы которых имеют одинаковое число валентных электронов, равное номеру группы. И поэтому эти химические элементы характеризуются повторяемостью химических, физических и некоторых других свойств их атомов и простых и сложных веществ при изменении порядкового номера.
Каждая группа делится на две подгруппы.
В главных подгруппах (А-группы) находятся химические элементы малых и больших периодов, в атомах которых происходит заполнение электронами внешнего энергетического уровня. Причём так, что число электронов на этом уровне равно номеру группы.
В побочных подгруппах (Б-группы) расположены химические элементы только больших периодов, в атомах которых электронами заполняется предвнешний энергетический уровень, а на внешнем уровне содержатся 1 или 2 электрона (у Pd – 0). Группа VIIIБ особая, она содержит триады химических элементов, составляющих семейства железа (Fe, Co, Ni) и платиновых металлов (Ru, Rh, Pd, Os, Ir, Pt).
Атомы элементов одной группы, но разных периодов отличаются друг от друга числом энергетических уровней (электронных слоёв). Сходство же их заключается в том, что вобразовании химических связей максимально может участвовать число электронов, равное номеру группы. В этом – физический смысл номера группы периодической системы Д.И. Менделеева.

Сходство химических элементов в подгруппах – наиболее заметная и важная закономерность в периодической системе. В атомах элементов побочных подгрупп (Б-групп) валентными являются электроны не только внешних, но и предвнешних электронных слоёв. И в этом заключаются основные различия в свойствах атомов элементов групп А и Б.
Пример. На каком основании элементы хлор и марганец помещены в одной группе, но в разных подгруппах Периодической системы Д.И. Менделеева?
Решение. Электронные формулы атомов в основном и возбуждённом состояниях:
Cl – 1s22s22p63s23p5, Mn 1s22s22p63s23p63d54s2.
Валентные электроны атома хлора – 3s23р5, марганца –3d 5 4s2. Таким образом, эти химические элементы не являются электронными аналогами и не должны размещаться в одной подгруппе. Однако на валентных орбиталях атомов этих элементов в возбуждённом состоянии максимально может находиться одинаковое число электронов – 7.
Сl 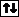
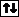
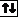
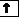
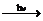 Сl*
Сl* 
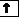
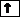
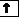
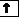
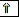
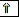 3 s 3 p 3 s 3 p 3 d
3 s 3 p 3 s 3 p 3 d
Mn 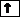
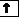
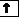
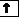
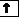
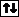
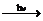 Mn*
Mn* 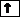
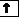
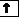
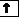
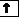
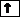
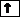
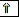
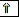
3 d 4 s 3 d 4 s 4 p
На этом основании элементы хлор и марганец помещены в седьмую группу Периодической системы, но в разные подгруппы.
В зависимости от того, какой энергетический подуровень (s, p, d или f) в атоме заполняется электронами последним, различают s -, p-, d- и f -элементы.
s -Элементы – элементы главных подгрупп I и II групп (IA- и IIА-групп), а также элементы 1-го периода Н и He. Валентными электронами в атомах этих элементов являются электроны n s -орбиталей.
p -Элементы – элементы шести главных подгрупп III–VIII-групп (групп IIIA–VIIIA). Валентными электронами в атомах этих элементов являются электроны n s - и n р -орбиталей.
d -Элементы – элементы побочных подгрупп – расположены в десяти столбцах восьми групп: IIIБ–VIIIБ, а также IБ и IIБ. В атомах этих элементов происходит заполнение электронами пяти орбиталей (n – 1) d -подуровня, то есть d -орбиталей предвнешнего энергетического уровня. Валентными электронами атомов этих элементов являются s-электроны внешнего энергетического уровня, и, в большинстве случаев, d-электроны предвнешнего уровня. Поэтому атомы d-элементов в химических соединениях обычно проявляют переменную валентность.
Например, марганец проявляет валентности II, IV, VI, VII.
f -Элементы – это лантаниды и актиниды, в атомах которых идёт заполнение семи орбиталей (n – 2) f -подуровня, то есть f -орбиталей предпредвнешнего энергетического уровня. Валентными электронами в них являются n s-, а также (n – 1) d - и (n – 2) f -электроны.
После рассмотрения электронного строения атома становятся очевидными принципы построения периодической системы Д. И. Менделеева.
1. Элементы в периодической системе образуют последовательность, соответствующую возрастанию заряда атомных ядер.
2. Каждый период начинается химическим элементом, в атомах которого происходит заполнение электронами нового энергетического уровня.
3. Число электронов на внешнем энергетическом уровне равно номеру группы (это относится к А-группам). Так, атомы Li, Na, К и других элементов, расположенных в IA-группе, имеют по одному электрону на внешнем уровне. Атомы элементов IIА-группы: Be, Mg, Ca и других имеют по два внешних электрона; а атомы F, C1, Вr и других элементов VIIA-группы содержат семь электронов на внешнем уровне.
Таким образом, внешний энергетический уровень (электронный слой) атомов элементов одной подгруппы имеет равное число электронов. Он периодически повторяется с ростом заряда ядра атомов. А поскольку химические реакции осуществляются за счёт внешних электронов атомов, то периодически повторяются и химические свойства элементов. В этом заключается суть Периодического закона.
Итак, периодическая система Д. И. Менделеева является естественной классификацией химических элементов по электронной структуре их атомов, о которой судят по положению элемента в соответствующих периоде и подгруппе периодической системы.
Для определения электронной конфигурации атома используют:
· порядковый номер элемента, определяющий число протонов в его ядре, а также число электронов в электронейтральном атоме;
· номер периода, указывающий на число энергетических уровней и номер внешнего уровня в атоме данного элемента;
· номер и тип группы (А или Б), которые указывают, к какому типу (s, p, d или f) относится данный химический элемент и сколько электронов в его электронейтральных атомах содержится на заполняемом энергетическом подуровне, а также на внешнем и предвнешнем энергетических уровнях.
Число электронов на внешнем уровне атома равно: номеру группы – для s - и р -элементов или двум – для d- и f -элементов с электронной конфигурацией n s 2 (исключение составляют атомы d- элементов: Cr, Cu, Nb, Mo, Ru, Rh, Ag, Pt, Au, имеющие один n s -электрон, а Pd – ноль).
Число электронов в атоме на заполняемом энергетическом подуровне для s -элементов равно номеру группы, для р -элементов – номеру группы минус 2, а для d - и f -элементов, соответственно на (n – 1) d - или (n – 2) f -подуровне, – обычно разности между номерами данного химического элемента и s -элемента IIА-группы того же периода.
Таким образом, на основе периодической системы Д.И. Менделеева можно определить электронную конфигурацию атомов любого элемента.
Определим, например, электронную конфигурацию электронейтрального атома элемента железа, находящегося в основном (невозбуждённом) состоянии.
1. Порядковый номер элемента железа 26, заряд атомного ядра +26, число электронов в атоме – 26.
2. Период – 4-й, значит, в атоме железа электроны занимают четыре энергетических уровня с подуровнями 1s 2 s 2 p 3 s 3 p 3 d4s.
3. Железо находится в VIIIБ-группе, то есть принадлежит к d -элементам, и в его атоме заполняется 3 d -подуровень.
4. На s -подуровне внешнего энергетического уровня имеется 2 электрона: 4 s 2.
5. На заполняемом 3 d -подуровне имеется 26 – 20 = 6 электронов: 3d6 (20 – порядковый номер кальция, элемента IIА-группы 4-го периода).
6. Остальные энергетические подуровни атома железа заполняются максимально возможным для них числом электронов.
Полная электронная формула атома железа:
26Fe 1s 22 s 22 p 63 s 23 p 6 4s 23 d 6.
7. Общее число электронов в атоме равно: 2 + 2 + 6 + 2 + 6 + 2 + 6 = 26, что соответствует порядковому номеру элемента железа.
Последовательность составления электронных формул атомов на основе местоположения элемента в периодической системе Д.И. Менделеева позволяет прежде всего определить электронное строение их внешних энергетических уровней атомов и тем самым выявить особенности, определяющие их химические свойства, то есть способность отдавать или присоединять электроны.
Атомы элементов, не имеющие на внешнем энергетическом уровне устойчивой электронной конфигурации n s 2n p 6, при химическом взаимодействии с атомами других элементов перестраивают свой внешний уровень для достижения устойчивой конфигурации. В зависимости от природы атомов это достигается тремя путями: отдачей, присоединением или обобществлением электронов с образованием химической связи. При этом атомы элементов с числом электронов на внешнем энергетическом уровне меньше четырёх обычно отдают электроны (являются восстановителями), а с числом больше четырёх – принимают электроны (являются окислителями).
Способность атома отдавать или присоединять электроны зависит от его радиуса и характеризуется величинами энергии ионизации и сродства к электрону, а в составе молекулы – относительной электроотрицательностью атома.
Периодичность повторения внешних электронных конфигураций атомов элементов приводит к периодическому изменению их свойств. В этом – физический смысл периодического закона.