Многие фосфорорганические соединения склонны к обратимым изомеризациям. Чаще всего такие изомеризации относятся к прототропным процессам, то есть явлениям, связанным с перемещением протона. Очень интересные результаты получены при изучении тиокислот пятивалентного фосфора:

На положение таутомерного равновесия влияет структура соединения, то есть природа заместителей Х и Y и растворитель. Так, тиофосфиновые кислоты (Х и Y – углеводородные радикалы) в спирте и воде обычно представлены почти полностью формой 1; моноэфиры фосфоновых кислот (Х – углеводородный радикал, Y – алкоксигруппа) в этих же растворителях существуют в виде смесей форм при преобладании 1. В то же время для диэфиров тиофосфорной кислоты (Х и Y – алкоксигруппа) положение кардинально изменяется – преобладает форма 2. В неполярных растворителях, например, в бензоле, почти все тиокислоты представлены формой 1. Фундаментальное изучение этой проблемы проведено академиком М.И. Кабачником. Важное значение имеет таутомерия гирофосфорильных соединений:

В основном эти вещества представлены формой 1; между тем, при переходе от обычных структур к системам с электроноакцепторными заместителями Х и Y начинает проявляться форма 2. В случае, когда эти заместители проявляют очень сильную электроноакцепторность (например, СF3), вещества существуют только в форме 2.
Прототропные процессы могут приводить к серьезным структурным изменениям веществ. Так, β-окси-алкилфосфиты проявляют высокую склонность переходить в так называемые гидрофосфораны. Проиллюстрируем сказанное таким примером:

Аналогично построенные γ-оксипропилфосфиты также являются таутомерными системами, однако форма 2 в равновесии представлена меньше. Рассмотренный тип обратимой изомеризации относится к хорошо известной кольчато-цепной таутомерии, широко распространенной в органической химии; напомним, что такая таутомерия характерна для моносахаридов. Большое внимание в настоящее время уделяется взаимным переходам производных пентакоординационного фосфора (фосфоранам). Так, форма 1 может превратиться в форму 2 и обратно по такому предлагаемому пути – обмен местами двух пар заместителей:
Подобные процессы могут происходить многократно, вовлекая в перемещения все заместители у фосфора. Благодаря такому перемещению может происходить рацемизация оптически активных фосфоранов и другие важные явления. Скорость изомеризации определяется природой заместителей, температурой и растворителем. Особое положение занимает изомеризация фосфоранов с одинаковыми заместителями, скажем, РF5. В этом случае вещество как бы превращается само в себя.
Как же можно следить за этим процессом? Привлечем F19 ЯМР-спектроскопию. Дело в том, что при понижении температуры возможно достижение такого положения, когда молекулы PF5 не изомеризуются. В этом случае по своим спектральным параметрам аксиальные (их два) и экваториальные (их три) фторы различаются, и спектр состоит из двух расщепленных сигналов. При повышении температуры спектральная картина сначала теряет свою четкость, а затем резко упрощается до одной линии. Наблюдаемые события объясняются изменением положения ядер фтора, в конечном случае они полностью усредняются между собой – молекула как бы становится живой. Подобные миграционные явления открыты и для случая перемещения фосфорной части молекулы относительно некоего стабильного остова. Для иллюстрации приведем случай обратимой изомеризации фосфорилированных амидинов:
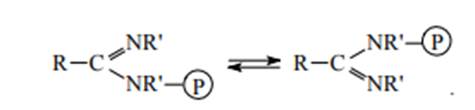
Два последних примера знакомят нас с так называемой вырожденной изомеризацией, изучение которой дало много для развития теоретической химии [4].