Теплота горения. Закон Гесса
Любое химическое превращение, при котором из одних веществ образуются другие, происходит за счёт перераспределения электронных структур атомов, ионов и молекул. Этот процесс сопровождается выделением или поглощением тепла, световым излучением, т.е. преобразованием химической энергии в другой вид энергии. Количество выделяемой или поглощаемой в ходе реакции теплоты называется тепловым эффектом процесса. Тепловые эффекты реакций изучает термохимия. Процесс горения происходит с выделением тепла, поэтому он относится к экзотермическим реакциям.
В 1840 г. Г. И. Гесс, обобщив имеющиеся экспериментальные данные по тепловым эффектам химических реакций, сформулировал закон, являющийся основным законом термохимии:
Тепловой эффект реакции при постоянных давлении или объёме зависит только от природы, состояния реагентов и продуктов реакции и не зависит от пути её протекания.
Закон Гесса используется для определения расчётным путём теплового эффекта реакции. Вычисления проводят на основе экспериментальных данных по стандартным теплотам образования (D 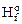 ) и сгорания (D
) и сгорания (D 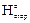 ) соединений, измеряемых в кДж/моль. Основной закон термохимии имеет следствие:
) соединений, измеряемых в кДж/моль. Основной закон термохимии имеет следствие:
Тепловой эффект реакции равен разности между суммой теплот образования продуктов реакции и суммой теплот образования реагентов с учётом их стехиометрических коэффициентов.
В практике пожарного дела под продуктами реакции следует понимать продукты горения, а под реагентами — горючее вещество и окислитель. Следовательно:
D 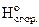 = S(n×D
= S(n×D  )п.г- S(n×D
)п.г- S(n×D  )г.в (3.1)
)г.в (3.1)
где
(D  )п.г. – теплоты образования продуктов реакции, кДж/моль;
)п.г. – теплоты образования продуктов реакции, кДж/моль;
(D  )г.в. – теплота образования горючего вещества, кДж/моль;
)г.в. – теплота образования горючего вещества, кДж/моль;
n – стехиометрические коэффициенты.
Теплотой образования называется тепловой эффект химической реакции образования данного соединения из простых веществ, отвечающих наиболее устойчивому состоянию простого вещества при стандартных условиях.
При этом теплота образования простых веществ (например, С, S, N2, O2) равна нулю.
Теплотой сгорания называется тепловой эффект химической реакции взаимодействия горючего вещества с кислородом с образованием продуктов полного окисления.
Различают низшую и высшую теплоту сгорания.
Низшая теплота сгорания – количество тепла, выделившееся при полном сгорании 1 кг, 1 м3, 1 кмоль вещества при условии, что водород, содержащийся в горючем веществе, сгорает с образованием воды, которая выделяется из зоны реакции в парообразном состоянии.
Высшая теплота сгорания – количество тепла, выделившееся при полном сгорании 1 кг, 1 м3, 1 кмоль вещества при условии, что водород, содержащийся в горючем веществе, сгорает с образованием воды, которая выделяется в жидком состоянии.
Поскольку в условиях пожара продукты горения имеют температуру, превышающую температуру кипения воды, то в дальнейшем будут приведены методики расчёта низшей теплоты сгорания.
Тепловой эффект реакции, вычисляемый по уравнению (3.1), не учитывает теплоту конденсации паров воды, поэтому в этом случае рассчитывается низшая теплота сгорания индивидуальных веществ.
D 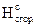 = Qн = S(n×D
= Qн = S(n×D  )п.г- S(n×D
)п.г- S(n×D  )г.в, кДж/моль (3.2)
)г.в, кДж/моль (3.2)
Низшая теплота сгорания может быть вычислена не только для 1 моль, но и для 1 кг или 1 м3 вещества. Для перевода значения низшей теплоты сгорания из кДж/моль в кДж/кг и кДж/м3 используют формулы:
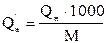 , кДж/кг
, кДж/кг
где
М – молярная масса вещества, г/моль
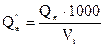 ,кДж/м3
,кДж/м3
где
Vt – объем 1 кмоль газа при заданных условиях, м3/моль.
Формула Менделеева
Методика расчёта низшей теплоты сгорания зависит от химического строения и агрегатного состояния вещества. Для сложных веществ переменного состава, находящихся в твёрдом и жидком агрегатных состояниях, а также сложных веществ постоянного состава, для которых отсутствует справочное значение теплоты образования, теплоту сгорания рассчитывают по формуле Д. И. Менделеева. В этом случае вычисления проводят с использованием массовых долей (%) элементов в горючем веществе.
Qн = 339.4×(С) +1257×(Н) –108.9×[(О)+(N)–(S)] – 25.1×[9×(Н) +(W)], кДж/кг
где (W) — массовая доля влаги в горючем веществе, %.
Сравнение расчетных и опытных данных по теплотворной способности разных веществ (дерево, торф, уголь, нефть) показало, что расчет по формуле Менделеева дает погрешность, не превышающую 10 %.
Для смеси газов низшая теплота сгорания рассчитывается по формуле:
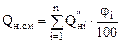 , кДж/м3
, кДж/м3
где
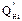 — низшая теплота сгорания i-ого компонента газовой смеси, кДж/м3;
— низшая теплота сгорания i-ого компонента газовой смеси, кДж/м3;
ji — объёмное содержание i-ого компонента газовой смеси, %(об);
n — число горючих компонентов газовой смеси.
Температура горения
Тепло, выделяющееся в зоне горения, легко воспринимается продуктами сгорания, поэтому они нагреваются до высокой температуры.
Максимальная температура, до которой нагреваются продукты горения, называется температурой горения.
Различают калориметрическую, адиабатическую, теоретическую и действительную температуры горения.
Под калориметрической температурой горения понимается температура, до которой нагреваются продукты горения при следующих условиях:
- начальная температура 273.15 К;
- коэффициент избытка воздуха 1;
- всё выделяющееся при горении тепло идёт на нагрев продуктов горения.
При определении адиабатической температуры горения учитывается состав горючей смеси, коэффициент избытка воздуха отличен от 1.
Теоретическая температура горения рассчитывается с учётом затрат тепла, расходуемых на диссоциацию продуктов горения.
Под действительной температурой горения понимают температуру, до которой нагреваются продукты горения в реальных условиях с учетом состава горючей смеси и теплопотерь.
Выделяющееся в зоне горения тепло расходуется на нагревание продуктов горения, на нагрев горючего вещества и окружающей среды.
Та температура, до которой в процессе горения нагреваются продукты горения, называется температурой горения. В технике и пожарном деле различают теоретическую, калориметрическую, адиабатическую и действительную температуру горения.
Теоретическая температура горения – это температура, при которой выделившаяся теплота горения смеси стехиометрического состава расходуется на нагрев и диссоциацию продуктов горения. Практически диссоциация продуктов горения начинается при температурах выше 2000 К.
Калориметрическая температура горения – это температура, которая достигается при горении стехиометрической горючей смеси с начальной температурой 273К и при отсутствии потерь в окружающую среду.
Теоретическая и калориметрическая температура горения парогазовых смесей широко используется при оценке пожарной опасности веществ. Кроме того, ее можно применять для расчета максимального давления взрыва при горении парогазовой смеси в замкнутом объеме.
Адиабатическая температура горения – это температура полного сгорания смесей любого состава (коэффициент избытка воздуха α > 1) при отсутствии потерь в окружающую среду.
Действительная температура горения – это температура горения, достигаемая в условиях реального пожара. Она намного ниже теоретической, калориметрической и адиабатической, т.к. в реальных условиях до 40 % теплоты горения обычно теряется на излучение, недожог и т.п.
Расчёт адиабатической и действительной температур горения основан на решении уравнения теплового баланса процесса горения.

где QПГ – количество тепла, затраченное на нагрев продуктов горения, кДж/моль, кДж/кг, кДж/м3;
VПГi – удельный объём продуктов горения, м3/кг;
СР i – среднее значение объёмной теплоёмкости продуктов горения, кДж/м3 К;
Тг – температура горения, К,
Т0 – начальная температура, равная 273 К.
Рассчитав энтальпию продуктов горения при нескольких температурах, методом линейной интерполяции определяют температуру горения.



