Лекция 8.
Оксид азота II (NO) имеет низкую растворимость в воде. Коэффициент поглощения  (объем газа, поглощенный одним объемом воды) при атмосферном давлении и различных температурах имеет следующие значения:
(объем газа, поглощенный одним объемом воды) при атмосферном давлении и различных температурах имеет следующие значения:
| Т, °С | ||||||

| 0,07381 | 0,05709 | 0,04706 | 0,03507 | 0,02954 | 0,0270 |
Вследствие чего NO не может быть использован для производства азотной кислоты, поэтому его подвергают дальнейшему окислению.
При окислении NO образуются высшие оксиды. Образование высших оксид протекает по реакциям:
 (1)
(1)
 (2)
(2)
 (3)
(3)
Оксиды азота имеют различную термодинамическую устойчивость, которая в свою очередь зависит от температуры.
| Температура, К | Термодинамические устойчивости различных оксидов, расположенные в порядке уменьшения |
| N2O4>N2O>N2O5>NO2>N2O3>NO | |
| NO>N2O>NO2>N2O3>N2O4>N2O5 |
Таким образом, при низких температурах наибольшей термодинамической устойчивость обладает N2O4, а при высоких – NO. Так как оксид азота II (NO) имеет низкую растворимость в воде, то его целесообразно окислять при низких температурах, когда его термодинамическая устойчивость наименьшая по сравнению с другими оксидами.
С понижением температуры равновесие реакций (1)-(3) смещается в сторону образования продуктов. При низких температурах и времени, достаточном для установления равновесия, а так же при избытке кислорода преобладающим продуктом окисления будет оксид N2O4. Об условиях превращений одних оксидов азота в другие и перехода их из газообразной фазы в жидкую и твердую можно судить по диаграмме состояния системы NO-NO2 при атмосферном давлении (рисунок 1).

| Рис. 1. Диаграмма состояния системы NO-NO2 при атмосферном давлении. |
При недостатке кислорода или неустановившемся равновесии в нитрозных газах могут одновременно содержаться N2O4, NO2, N2O3, NO.
Оксид азота N2O5 при окислении N2O4 кислородом не образуется, даже если процесс происходит при повышенном давлении. Оксид азота N2O5 может быть получен только окислением N2O4 озоном, при этом протекает реакция:
 .
.
Одновременно с образованием N2O5 может образовываться N2O6.
От степени полноты протекания реакции (1) будет зависеть остаточное содержание NO в газовой смеси. Поэтому при окислении оксида азота NO данная реакция является определяющей. Зависимость константы равновесия реакции:

выраженная через парциальные давления веществ имеет следующий вид:
 .
.
Существует эмпирическое уравнение, описывающее зависимость константы равновесия от температуры (уравнение Боденштейна):
 .
.
На рисунке 2 представлен график зависимости равновесной степени окисления оксида азота NO ( ) от температуры и давления при начальной концентрации 9,92% NO и 5,68 О2.
) от температуры и давления при начальной концентрации 9,92% NO и 5,68 О2.

| Рис. 2. Зависимость равновесной степени окисления оксида азота NO ( ) от температуры и давления при начальной концентрации 9,92% NO и 5,68 О2. Значения Р, МПа: 1 – 0,1; 2 – 0,8. ) от температуры и давления при начальной концентрации 9,92% NO и 5,68 О2. Значения Р, МПа: 1 – 0,1; 2 – 0,8.
|
Из диаграммы (рис. 2) следует, что понижение температуры и повышение давления газа смещают равновесие реакции в сторону образования продуктов. При температуре менее 200°С реакция окисления NO при давлении 0,1 МПа протекает почти на 100%. Поэтому при данных условиях реакцию можно рассматривать как протекающую необратимо в сторону образования NO2.
Окисление оксида азота NO протекает по уравнению реакции третьего порядка. Дифференциальное уравнение скорости окисления NO кислородом имеет вид:

где 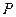 – парциальные давления соответствующих веществ в данный момент;
– парциальные давления соответствующих веществ в данный момент;  – константа скорости прямой реакции;
– константа скорости прямой реакции; 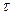 – время окисления, с.
– время окисления, с.
Значения констант скорости реакции, по данным М. Боденштейна, представлены в таблице 1.
Таблица 1
Константы скорости окисления NO кислородом при различных температурах и давлении 1 МПа

Для определения времени, необходимого для окисления NO до заданной степени, можно использовать уравнение:

где 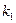 – константа скорости реакции;
– константа скорости реакции; 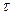 – время реакции;
– время реакции;  – половина начальной концентрации NO, объемный %;
– половина начальной концентрации NO, объемный %;  – начальная концентрация кислорода, объемный %;
– начальная концентрация кислорода, объемный %;  – расход кислорода на окисление NO; объемный %.
– расход кислорода на окисление NO; объемный %.
Степень окисления NO в долях единицы можно при помощи уравнения: 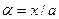 .
.
На рисунке 3 представлена номограмма для определения скорости окисления NO.

Рис. 3. Номограмма для определения скорости окисления NO.
На номограмме:  – отношение концентрации кислорода к половине концентрации NO, то есть
– отношение концентрации кислорода к половине концентрации NO, то есть  ;
;  и есть скорость окисления NO при различных значениях
и есть скорость окисления NO при различных значениях  .
.
Реакция окисления NO является суммой двух бимолекулярных реакций:


Первая реакция протекает быстро, вторая – медленно. С повышением температуры равновесие первой реакции смещается в сторону исходных веществ, концентрация NO3 уменьшается, поэтому реакция образования NO2 замедляется. С понижением температуры концентрация NO3 увеличивается, что приводит к ускорению второй реакции, которая и определяет общую скорость процесса.
Реакция окисления NO кислородом относится к тем немногочисленным процессам, скорость протекания которых с понижением температуры увеличивается.
Как видно из уравнения кинетики окисления NO, скорость реакции давлению во второй степени. То есть если увеличить общее давление в 2 раза, то скорость окисления увеличится в четыре раза.
В действительности практически невозможно достичь 100% окисления NO в NO2, так как для этого требуется высокое давление, высокие концентрации NO и кислорода в исходных реагентах (другими словами исходные газы должны содержать как можно меньше примесей в своем составе).
Образование оксида азота IV N2O4.
Переработка нитрозных газов зачастую производят при низких температурах. В этих условиях двуокись азота практически не существует, часть ее всегда полимеризуется в четырех окись азота:

Степень полимеризации тем выше, чем ниже температура и больше концентрация двуокиси азота NO2. Процесс диссоциации (распада молекулы N2O4 на NO2) имеет обратную зависимость.
Зависимость содержания диоксида азота (NO2) и четырех окиси азота (N2O4) от температуры можно проследить по следующим данным:
| Температура, °С | |||
| Содержание NO2, % об. | 31,0 | 88,0 | ~100 |
Зависимость константы равновесия (полимеризации NO2) от температуры имеет следующий вид (уравнение М. Боденштейна):
 .
.
Для менее точных расчетов можно использовать уравнение:
 .
.
Скорости протекания процессов как полимеризации диоксида азота, так и обратной реакции диссоциации существенно превышают скорость окисления оксида азота NO. Так равновесие реакции полимеризации устанавливается примерно за 10-4 с, а процесса окисления оксида азота NO примерно за 0,1 с.
Жидкий N2O4 растворяется в воде ограничено. Поэтому процесс необходимо проводить при температуре не менее 30°С чтобы избежать его конденсации.
Образование оксида азота N2O3.
Образование N2O3 протекает по реакции:
 .
.
Равновесие данной реакции сдвигается в сторону образования продуктов при уменьшении температуры и повышении давления. В таблице 2 представлено содержание N2O3 в эквимолекулярной (другими словами стехиометрической) смеси NO+NO2 при различных температурах и давлениях.
Таблица 2
Содержание N2O3 в эквимолекулярной (стехиометрической) смеси NO+NO2 при различных температурах и давлениях.

Если известны парциальные давления NO, NO2, N2O4, то можно определить концентрацию N2O3 при помощи уравнения:

Скорость образования N2O3 можно определить при помощи уравнения:
 .
.
Равновесие данной реакции достигается более быстро, чем равновесие реакции окисления NO. Таким образом, из всех возможных реакций, протекающих при окислении NO, наименьшей скоростью обладает реакция непосредственно окисления NO с образованием NO2. Данная стадия является лимитирующей.
Из литературных источников известно, что ускорить реакцию окисления NO можно за счет использования катализаторов. Установлено, что при низких температурах активны катализаторы адсорбционного типа (синтетические цеолиты, активированные угли). При содержании NO до 1,5%, объемной скорости 15000 ч-1, в интервале температур 293-350 К такие катализаторы ускоряют реакцию в 35-65 раз по сравнению с гомогенным окислением.
В качестве высокотемпературных катализаторов в литературных источниках предлагаются катализаторы на основе оксидов никеля и кобальта с добавками оксидов циркония, марганца, серебра. Катализаторы данного состава способны ускорять реакцию окисления при температурах до 640 К. Отрицательно влияют на скорость наличие паров воды, увеличение содержания NO и NO2.
Механизм реакции каталитического окисления NO можно описать при помощи уравнений:
1. O2 + 2kt → 2ktO;
2. NO + kt → ktNO;
3. ktNO + ktO → ktNO2 + kt;
4. ktNO2 → NO2 + kt.
В таблице 3 представлены значения скорости окисления NO при использовании высокотемпературных катализаторов различного состава.
Таблица 3
Скорость окисления NO при использовании высокотемпературных катализаторов различного состава и при различных температурах.
