ПОЛУЧЕНИЕ НИТРОФОСКИ.
АНАЛИЗ ГОТОВОГО ПРОДУКТА
Учебно-методическое пособие
Киров 2015
УДК 661.5 (07)
М 69
Допущено к изданию методическим советом химического факультета ФГБОУ ВПО «ВятГУ» в качестве учебно-методического пособия для студентов, обучающихся по направлению 240100.62 «Химическая технология», профиля подготовки 240100.62.06 «Технология неорганических веществ» всех форм обучения
Рецензент:
доцент кафедры НиФХ ФГБОУ ВПО «ВятГУ»,
кандидат технических наук
Е.Г.Фоминых
Михайлова, И.Ю.
М 69 Получение нитрофоски. Анализ готового продукта. Учебно-методическое пособие / И. Ю. Михайлова. – Киров: ФГБОУ ВПО «ВятГУ», 2014. – 23 с.
УДК 661.5 (07)
Учебно-методическое пособие предназначено для студентов, обучающихся по направлению 240100.62 «Химическая технология», профиля подготовки 240100.62.06 «Технология неорганических веществ», всех форм обучения для выполнения лабораторных работ по дисциплине «Химическая технология неорганических веществ».
Тех. редактор Е. В. Кайгородцева
© ФГБОУ ВПО «ВятГУ», 2015
СОДЕРЖАНИЕ
СОДЕРЖАНИЕ. 3
1. НИТРОФОСКА. СПОСОБЫЕЕ ПОЛУЧЕНИЯ.. 4
2. ВЫПОЛНЕНИЕ РАБОТЫ.. 6
2.1. Получение нитрофоски. 7
2.1.1. Получение нитрофоски фосфатным способом. 10
2.1.2. Получение нитрофоски карбонатным способом. 10
2.1.3. Получение нитрофоски сульфатным способом. 11
2.1.4. Порядок выполнения работы.. 12
2.1.5. Обработка результатов. 13
2.2. Анализ нитрофоски. 15
2.2.1. Определение нитратного азота ускоренным методом. 15
2.2.2. Определение фосфатов фотоколориметрическим методом. 18
3. ТЕХНИКА БЕЗОПАСНОСТИ.. 21
4. КОНТРОЛЬНЫЕ ВОПРОСЫ.. 22
5. СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ.. 23
1. НИТРОФОСКА. СПОСОБЫЕЕ ПОЛУЧЕНИЯ [1-3]
Нитрофоска – сложное удобрение, содержащее три основных элемента (N, P, K) для питания растений, количественное соотношение которых может быть различным.
Фосфор содержится в цитратно-растворимой форме в виде дикальцийфосфата СаНРО4 и в водорастворимой форме в виде фосфата аммония NH4H2PO4.
Азот содержится в нитратной форме в виде нитрата калия KNO3, в аммонийной форме в виде фосфата аммония NH4H2PO4 и хлорида аммония NH4Cl и в аммонийно-нитратной форме – в виде нитрата аммония NH4NO3.
Калий содержится в виде хлорида калия KCl и нитрата калия KNO3.
Нитрофоска выпускается в виде гранул белого цвета, обладает низкой гигроскопичностью и слёживаемостью. При содержании влаги до 2 % нитрофоска удовлетворительно рассеивается, при влажности 5 % – плохо, является нейтральным и универсальным удобрением.
Преимущества нитрофоски по сравнению с другими видами простых и сложных удобрений:
1) высокое содержание питательных веществ – азота, фосфора и калия;
2) высокая агрономическая эффективность;
3) возможность изменять соотношения питательных веществ, и, следовательно, применять удобрение на разных почвах и под различные культуры;
4) однородное и тонкое распределение питательных компонентов в массе удобрения;
5) хорошие физические свойства, позволяющие вносить удобрения механизированным путем без предварительного дробления и другой дополнительной обработки.
Способы получения сложных удобрений делятся на две основные группы:
ü способы, базирующиеся на использовании фосфорных кислот;
ü способы, основанные на азотнокислотном или сернокислотном разложении фосфатов.
Такое деление условно, так как оба направления включают и смешанные способы, в которых в процессе разложения фосфатного сырья помимо основной используется также и вторая кислота.
Наиболее распространенным способом производства нитрофосфатов (нитрофоски и азотофоски) является способ, основанный на разложении природных фосфатов азотной кислотой с последующей переработкой образующегося раствора (вытяжки), содержащего Ca(NO3)2 и свободную H3PO4, в сложные азотно-фосфорно-калийные удобрения.
В зависимости от метода переработки вытяжки получают как простые азотные и фосфорные, так и сложные двойные (N–P2O5) или тройные (N–P2O5–K2O) удобрения с различным соотношением питательных веществ. В отличие от сернокислого метода, при азотнокислом разложении фосфатного сырья используется не только химическая энергия кислоты, но и содержащийся в ней азот, который переходит в состав удобрения.
Разложение фосфатов азотной кислотой является сложным процессом, протекает по реакции:
Ca5(PO4)3F + 10HNO3 = 3H3PO4 + 5Ca(NO3)2 + HF. 1
Полученный раствор (вытяжку) перерабатывают в конечный твердый продукт, состоящий из фосфатов, нитратов и других соединений кальция, аммония, калия, магния. Этот состав зависит от способов переработки азотнокислой вытяжки. В основе большинства способов получения сложных удобрений лежит реакция нейтрализации азотнокислой вытяжки аммиаком.
При нейтрализации вытяжки аммиаком образуется пульпа, твердая фаза которой содержит CaHPO4, а жидкая NH4NO3 и Ca(NO3)2:
5Ca(NO3)2 + 3H3PO4 + 6NH3 = 3CaHPO4 + 6NH4NO3 + 2Ca(NO3)2. 2
Получаемый по этому способу продукт содержит P2O5 в нежелательной цитраторастворимой форме и Ca(NO3)2, обладающий повышенной гигроскопичностью. Нитрат кальция, содержащийся в вытяжке, стараются переводить в карбонат или сульфат кальция. В последнем случае возможно получение удобрения, содержащего P2O5 частично в водорастворимой форме виде Ca(H2PO4)2·H2O или NH4H2PO4, так как некоторое количество кальция выводится из раствора до его нейтрализации.
Полученную пульпу смешивают с калийной солью (если она не была введена раньше в процессе подготовки пульпы) и высушивают в смеси с ретуром готового продукта.
Ретур – возвратная мелкая фракция высушенного порошкообразного готового продукта, добавляемого к свежеполученному влажному материалу для снижения его влажности.
ВЫПОЛНЕНИЕ РАБОТЫ
Цель работы: познакомиться с основными способами производства сложных удобрений – нитрофосок. Получить на лабораторной установке нитрофоску из азотнокислотной вытяжки. Выполнить анализ готового продукта на содержание нитратного азота ускоренным методом и фосфатов фотоколориметрическим методом по желтому фосфорнованадиевомолибденовому комплексу.
2.1. Получение нитрофоски [4]
Получение нитрофоски проводят фосфатным, карбонатным или сульфатным способами на установке, схема которой представлена на рис.1.
В качестве исходного полупродукта используют азотнокислотную вытяжку, полученную и проанализированную в лабораторной работе «Разложение апатита. Получение и анализ азотнокислотной вытяжки».
Получение нитрофоски заключается в обработке азотнокислотной вытяжки аммиаком:
· при получении фосфатной нитрофоски в вытяжку вводят дополнительное количество фосфорной кислоты и нейтрализуют полученный раствор аммиаком;
· при получении карбонатной нитрофоски нейтрализацию вытяжки аммиаком ведут при одновременной карбонизации раствора карбонатом калия;
· при получении сульфатной нитрофоски нейтрализацию вытяжки аммиаком совмещают с обработкой раствором серной кислоты.
Полученную тем или иным способом нейтрализованную пульпу смешивают с калийными солями для создания требуемого соотношения между питательными элементами (11–20 % N, 8–16 % P2O5, 10–21 % K2O) и высушивают.
Производство нитрофоски карбонатным способом характеризуется наименьшими капиталовложениями и наиболее низкой себестоимостью продукции. Однако получающееся этим способом удобрение содержит фосфорный ангидрид P2O5 в цитраторастворимой форме, вследствие этого оно пригодно лишь для кислых почв. Сульфатным и фосфатным способами получают частично водорастворимую нитрофоску (содержание от общего её количества в водорастворимой форме до 40–50 %).
Перед выполнением работы (по любому из трех предполагаемых способов) определяют количества компонентов, содержащихся в объеме вытяжки Vв (150–200 см3) и заполняют табл.1.
Таблица 1
Состав азотнокислотной вытяжки
| Объем вытяжки Vв, мл | Содержание компонентов | |||||
| в расчете на 1 л, г/л | в расчете на Vв, г | |||||
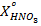
| 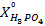
| 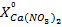
| 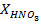
| 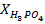
| 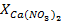
| |
В вытяжке кальций находится в виде Ca(NO3)2. Пересчет 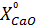 в
в
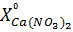 (г/л) осуществляется по формуле:
(г/л) осуществляется по формуле:
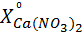 =
= 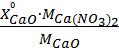 , (1)
, (1)
где 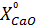 – содержание кальция в виде CaO, г/л;
– содержание кальция в виде CaO, г/л;
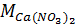 и
и 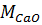 – молярные массы Ca(NO3)2 и CaO, г/моль.
– молярные массы Ca(NO3)2 и CaO, г/моль.
Приборы, оборудование, материалы и реактивы:
· установка для получения нитрофоски: полипропиленовый стакан емкостью 0,8 л – нейтрализатор, магнитная мешалка, водяная баня для охлаждения, капельные воронки (бюретки), термометр;
· электронные весы;
· фарфоровая чашка для выпаривания;
· электроплитка;
· сушильный шкаф;
· ступка с пестиком для растирания готового продукта.
Реактивы: азотнокислотная вытяжка; раствор аммиака (25 %-й); H3PO4 (конц.), H2SO4 (конц.); K2СO3 (крист.); KCl (крист.); KNO3 (крист.).
Индикаторы: универсальная индикаторная бумага.

Рис.1 – Установка для получения нитрофоски:
1 – нейтрализатор; 2 – водяное охлаждение; 3 – магнитная мешалка; 4, 5 – капельные воронки (бюретки); 6 – спиртовый термометр; 7 – регулятор скорости вращения магнитной мешалки
Получение нитрофоски фосфатным способом
Расчет необходимых количеств фосфорной кислоты и раствора аммиака проводят по следующим уравнениям реакций:
Ca(NO3)2 + 2H3PO4 + 3NH3 = CaHPO4 + NH4H2PO4 + 2NH4NO3, 3
HNO3 + NH3 = NH4NO3 4
Расчет ведут по формулам, учитывая, что норма фосфорной кислоты равна 100%, а норма аммиака – 120%:
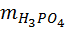 =
=  ; (2)
; (2)
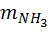 = [
= [ 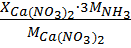 +
+ 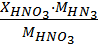 ]∙
]∙ 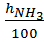 , (3)
, (3)
где 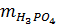 ,
, 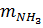 – массы H3PO4 и NH3 (в расчете на 100 %), г;
– массы H3PO4 и NH3 (в расчете на 100 %), г;
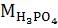 ,
, 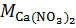 ,
, 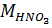 ,
, 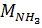 – молярные массы H3PO4, Ca(NO3)2 , HNO3, NH3 соответственно, г/моль.
– молярные массы H3PO4, Ca(NO3)2 , HNO3, NH3 соответственно, г/моль.
Требуемые объёмы растворов фосфорной кислоты и аммиака находят c учётом плотности растворов и содержания основного вещества, с помощью мерных цилиндров их переносят в капельные воронки 4, 5.
Количество добавок: KCl и KNO3 – задаётся преподавателем.