Тема: Карбоновые кислоты.
Цель. Изучить строение и свойства класса карбоновые кислоты.
Строение молекулы карбоновых кислот
Карбоксильная группа сочетает в себе две функциональные группы – карбонил и гидроксил, взаимно влияющие друг на друга.
2. Физические свойства 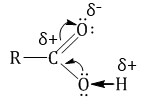
В жидком состоянии и в растворах молекулы карбоновых кислот образуют водородные связи вызывают притяжение и ассоциацию молекул карбоновых кислот.
Молекулы карбоновых кислот с помощью водородных связей соединены в димеры.
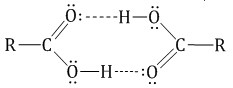
Это приводит к увеличению растворимости в воде и высоким температурам кипения низших карбоновых кислот.
С увеличением молекулярной массы растворимость кислот в воде уменьшается.
Некоторые представители даны в таблице (внимательно изучить).
Таблица.
Предельные одноосновные карбоновые кислоты.
| Тривиальное название | Систематическое название | Название соли и эфира | Формула кислоты |
| Муравьиная | Метановая | Формиат (метаноат) | HCOOH |
| Уксусная | Этановая | Ацетат (этаноат) | CH3COOH |
| Пропионовая | Пропановая | Пропионат (пропаноат) | CH3CH2COOH |
| Масляная | Бутановая | Бутират (бутаноат) | CH3(CH2)2COOH |
| Валериановая | Пентановая | Пентаноат | CH3(CH2)3COOH |
| Капроновая | Гексановая | Гексаноат | CH3(CH2)4COOH |
| Пальмитиновая | Гексадекановая | Пальмитат | С15Н31СООН |
| Стеариновая | Октадекановая | Стеарат | С17Н35СООН |
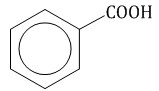 бензойная кислота, ароматическая кислота.
бензойная кислота, ароматическая кислота.
Изомерия.
Для предельных карбоновых кислот характерна структурная изомерия – изомерия углеродного скелета и межклассовая изомерия.
Структурные изомеры – это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
|
|
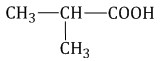
Изомеры углеродного скелета характерна для карбоновых кислот, которые содержат не менее четырех атомов углерода. Например:Формуле С4Н8О2 соответствуют бутановая и 2-метилпропановая кислота
Бутановая кислота 2- метилпропановая кислота
 |
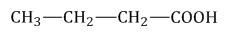
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Карбоновые кислоты изомерны сложным эфирам. Общая формула и спиртов, и простых эфиров — C n H 2n О 2.
| СН3–CОOH уксусная кислота | HCOOCH3 эфир метилового спирта и муравьиной кислоты |
Свойства карбоновых кислот.
Карбоновые кислоты – кислоты средней силы.
В водном растворе карбоновые кислоты частично диссоциируют на ионы:
R–COOH ⇆ R-COO– + H+
2. Карбоновые кислоты реагируют с большинством оснований. При взаимодействии карбоновых кислот с основаниями образуются соли карбоновых кислот и вода.
CH 3 COOH + NaOH = CH 3 COONa + H 2 O
Карбоновые кислоты реагируют с щелочами, амфотерными гидроксидами, водным раствором аммиака и нерастворимыми основаниями.
CH 3 COOH + Mg(OH)2 = (CH 3 COO)2Mg + 2H 2 O
3. Карбоновые кислоты реагируют с активными металлами. При взаимодействии карбоновых кислот с металлами образуются соли карбоновых кислот и водород ↑.
CH 3 COOH + Mg = (CH 3 COO)2Mg + H 2↑
4. Карбоновые кислоты реагируют с основными оксидами с образованием солей карбоновых кислот и воды.
CH 3 COOH + CaO = (CH 3 COO)2Ca + 2H 2 O
5, Карбоновые кислоты вступают в реакции с одноатомными и многоатомными спиртами с образованием сложных эфиров.
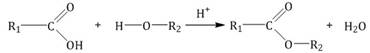
| Например,этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты): |
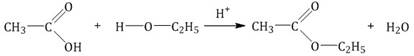
|
|
Заключение. Карбоновые кислоты реагируют на индикатор, дают кислую реакцию среды, рН <7, т.к. в растворе есть ионы водорода Н+.
Взаимодействуют с металлами, оксидами и гидроксидами металлов с образованием солей. (Названия в таблице), соль - название углеводорода с окончанием - ат., соли уксусной кислоты называются ацетаты. Взаимодействуют со спиртами с образованием сложных эфиров.
А) состоит из названия радикала от спирта и кислотного остатка – этилацетат, метилбутанат и т. д. Б)- начинается с кислоты: уксусноэтиловый эфир. В) полностью: этиловый эфир уксусной кислоты