Элементарные стадии химических реакций (основы теории)
При записи механизма реакции или при выдвижении набора механизмов (набора гипотез о механизмах) необходимо учитывать основные теоретические положения (постулаты, законы, принципы) и эвристические правила, которые позволяют оценить вероятность отнесения той или иной реакции к элементарным стадиям. Количественный ответ на этот вопрос дают пока еще очень трудоемкие профессионально выполненные квантово-химические расчеты. Поэтому использование простых правил и представлений о реакционной способности очень полезно.
В этом разделе мы рассмотрим очень кратко основные выводы и следствия различных теорий элементарной стадии, повторив и основные понятия химической кинетики.
Основные понятия химической кинетики
Концентрация вещества C определяется количеством молекул (или молей) в единице объема.
Число частиц должно быть большим, чтобы величину концентрации С можно было рассматривать как величину статистическую и одинаковую в любой части реакционного объема.
В системе устанавливается равновесное распределение частиц по внутренним степеням свободы (энергиям) и по скоростям поступательного движения – максвелл-больцмановское распределение (МБР). Между возбужденными и невозбужденными состояниями устанавливается статистическое (термическое) равновесие, характеризуемое одной температурой. Если химические реакции не нарушают термического МБР, то кинетику таких реакций называют “равновесной”. К равновесной кинетике относятся большинство реакций в газах, растворах и на поверхности при T < 1000оС. Неравновесная кинетика исследует фотохимические, плазмохимические реакции, процессы горения и взрыва.
Взаимодействие нескольких частиц (реагентов) с образованием молекул (частиц), называемых продуктами реакции, проходящее через один потенциальный барьер, называют элементарным актом химического процесса. Многократное повторение таких актов с участием большого числа молекул (частиц), называют элементарной реакцией или элементарной стадией (ЭС).
Число участников (реагентов) ЭС называют молекулярностью ЭС. Молекулярность m есть сумма стехиометрических коэффициентов участников ЭС ( ).
).
Скорость реакции. Изменение количества молей i-того участника стадии (∆ni) в результате химической реакции определяется скоростью ri образования или расходования ni, временем реакции t и объемом V: Dni = j(ri, t, V). Поэтому скорость реакции ri есть производная второго порядка от ni по V и t:
 (1)
(1)
Если ri одинакова по всему объему и V = const (закрытая система), то Dni µ V, и дифференцирование по V заменяется делением на V:
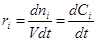 (2)
(2)
Если в открытой системе реакция стационарна, то Dni µ t, и дифференцирование по t заменяется делением на t (реактор идеального вытеснения):
 (3)
(3)
где Fi – мольный поток (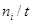 ).
).
Если выполнены оба условия (безградиентный проточный реактор, реактор полного смешения), то скорость  или
или 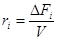 .
.
Скорость j-той стадии при V = const есть производная степени глубины реакции c по времени в единице объема
 , где
, где 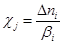 (4)
(4)
отсюда
 (5)
(5)
Изложенные соображения справедливы и для участников итоговых уравнений стационарных, квазистационарных и нестационарных реакций.
Основные законы, постулаты и принципы
Рассмотрим основные законы, постулаты, принципы и эвристические правила, лежащие в основе теории элементарной стадии:
Законы сохранения массы и элементов в ходе химической реакции (в закрытой системе):
 (6)
(6)
 (7)
(7)
где  – вектор-строка стехиометрических коэффициентов участников реакции,
– вектор-строка стехиометрических коэффициентов участников реакции,  – вектор-столбец молекулярных масс участников реакции, H – атомная (молекулярная) матрица.
– вектор-столбец молекулярных масс участников реакции, H – атомная (молекулярная) матрица.