| Определяемая концентрация | И с х о д н а я к о н ц е н т р а ц и я | |||
| С масс. доли, % | Молярная, См, моль/л | Молярная концентрация эквивaлента СN(моль/л) | Титр, Т, г/мл | |
| С масс. доли, % Число граммов вещества в 100 граммах раствора | C%= 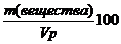
| C%= 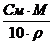
| C%  = = 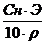
| C% = 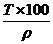
|
| Молярная, См, моль/л, Кол-во молей вещества в 1 литре раствора | См= 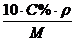
| См = 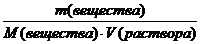
| См = 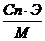
| См = 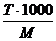
|
| Молярная концентрация эквивлента, СN(моль/л) Кол-во моль эквивалентов в 1 литре раствора | СN =  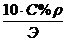
| СN = 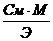
| СN = 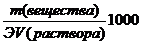
| СN = 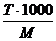
|
| Титр, Т, г/мл Число граммов вещества в 1 мл раствора | Т = 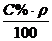
| Т = 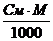
| Т = 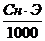
| Т = 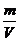
|
Методические рекомендации по выполнению задания «Растворы».
Определение концентрации растворенного вещества или массы (количества) вещества в растворе с определенной концентрацией.
Задача 1. Хлороводород массой 25г растворили в 75 г воды. Определите массовую долю хлороводорода в полученном растворе.
Дано: Решение
m (НС1) =25г
m (Н2О) = 75 г w (НС1) = 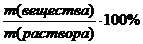
Найти: w (НС1) =? m (раствора) = m (НС1) + m (Н2О) =25+75=100г
w (НС1) = 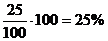
Ответ: w (НС1) = 25%
Задача 2. В 500 мл раствора содержится 112 г гидроксида калия.
Определите молярную концентрацию раствора.
Дано: V(раствора) = 500мл Решение
m(KOH) = 112 См (КОН) = 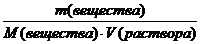
Найти: См (КОН)=? См (КОН) = 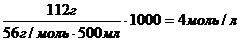
Ответ: См (КОН)= 4моль/л
Приготовление раствора определенной концентрации
Задача 3. Какую массу хлорида хрома (111) и воды надо взять для
приготовления 600г 30% раствора?
Дано: m(раствора) =600г Решение
w (CrCl3) = 30% w = 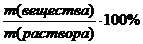
Найти m(CrCl3)=?
m(H2O)=?
m(CrCl3) = 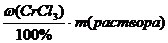 =
= 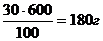
m(H2O) = 600г – 180 г = 420 г
Ответ: m(CrCl3)=180г; m(H2O) = 420 г
Разбавление (концентрирование) растворов 
 При добавлении к раствору воды (разбавление) или упаривание раствора (концентрирование) изменяется общее количество раствора (масса, объём), а количество растворённого вещества остается неизменным.
При добавлении к раствору воды (разбавление) или упаривание раствора (концентрирование) изменяется общее количество раствора (масса, объём), а количество растворённого вещества остается неизменным.
Задача 4. Из 170г 30% раствора серной кислоты упариванием удалили 30г воды. Найдите массовую долю серной кислоты в полученном растворе.
Дано: m1(раствора) =170г Решение 
m(H2O) =30гw = 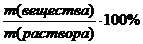
Найти: w(H2SO4)=? 1. Найдем массу серной кислоты до
упаривания
m (H2SO4)= 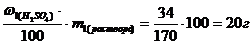
Найдем массу раствора после упаривания
m2(раствора) = 170г - 30г = 140г
3.Учитывая, что масса H2SO4 не изменилась,
найдем концентрацию раствора после упаривания
w2(H2SO4)= 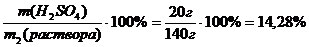
Ответ: w2(H2SO4)=14,28 %
Задачи на смешивании растворов разных веществ.
* Задачи этого типа являются простейшими комбинированными задачами, объединяющими задачи, связанные с концентрацией растворов и различные расчеты по химическим уравнениям. Если в условии задачи даны массы раствора и его массовая доля или объём раствора и его молярная концентрация, советуем начать решение задачи с определения количества вещества, вступившего в реакцию
Задача 2. Какая масса раствора карбоната калия с массовой долей 20% требуется для реакции со 100 мл 2М раствора хлорида кальция?
Дано: w(K2CO3) = 20% Решение
V (CaCl2) = 100 мл =0,1л
Смраствора (СаС12)=2моль/л 1. Определим n(CaCl2) из условия
a. задачи:
Найти: m (K2CO3)=?
М(CaCl2)= 111г/моль
М(K2CO3) = 138г/моль
См = 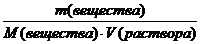 ,
,  m(вещества) = См
m(вещества) = См 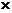 М(вещества)
М(вещества) 
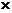 V(раствора) = 2
V(раствора) = 2 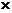 111
111 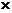 0,1 = 22,2г
0,1 = 22,2г
n(CaCl2) = 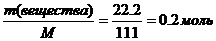
K2CO3 + CaCl2 = 2KCl + CaCO3¯
n(CaCl2) =n(K2CO3) = 0,2моль
m (K2CO3)=n(K2CO3) 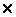 М(K2CO3)= 0.2
М(K2CO3)= 0.2 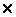 138 = 27.6г
138 = 27.6г
массу раствора K2CO3 находим из формулы: w (K2CO3) = 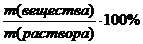 , m(раствора) =
, m(раствора) = 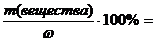
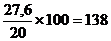 г
г
Ответ: m(раствора) = 138 г